ウイルス感染とアルツハイマー病(AD)および認知症発症・進行を結びつける要因として、活性酸素種(ROS)が重要な役割を果たしていることを示すエビデンスが増えている。
単純ヘルペスウイルス(HSV-1)、CMV、ジカウイルス、エンテロウイルス、HIV、SARS-CoV-2といった多くのウイルスは、ミトコンドリア機能障害、NADPHオキシダーゼの活性化、宿主の抗酸化防御機構の抑制などの機序を通じて感染細胞内でROS産生を誘導する。その結果生じる酸化ストレスは、神経炎症、タンパク質の誤折り畳み、シナプス喪失、神経細胞死といった、ADをはじめとする神経変性疾患における一連の有害プロセスを促進する。
HSV-1は神経細胞内に長期潜伏感染を成立させ、持続的な酸化ストレス源となることでADや他の認知症亜型の進行を加速させる可能性がある。
軽度から中等度のCOVID-19もAD関連疾患に寄与する可能性があると最近の研究で示唆されており、科学界および一般社会の双方が真剣に受け止めるべきだろう。
近年の研究のよって、ウイルス感染と神経変性疾患との関連性は治療における新たな方向性を提示している。抗ウイルス治療、ワクチン、ならびに神経変性の軽減を目的とした介入は様々なタイプの認知症の進行を予防または抑制する新しい戦略となる可能性を秘めている。
リンクのレビューは、ウイルスによるROS産生に関するエビデンスを包括的に整理し、ウイルス感染とADRDとの関係におけるROSの役割を検討したもの。
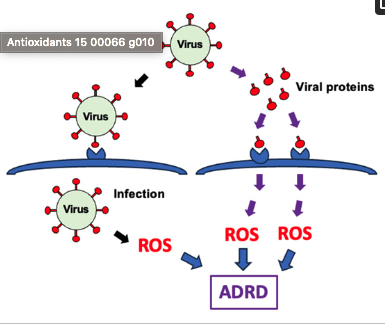
特定のウイルス感染は、ADやその他の認知症を含む様々な合併症の病態形成に関与していることが示唆されているが、ウイルス感染とアルツハイマー病および関連認知症(ADRD)との関連における活性酸素種(ROS)の役割については議論が分かれており、明確にはなっていない。
通常、ウイルスは膜融合タンパク質を介して細胞表面受容体と相互作用することで宿主細胞内に侵入する。重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による新型コロナウイルス感染症(COVID-19)のパンデミックによって、ウイルス感染合併症を呈する患者の血中スパイクタンパク質などの遊離ウイルス融合タンパク質が、病理学的役割を果たす可能性が注目されるようになった。
最近の報告では、SARS-CoV-2感染がAD様病理の増加を引き起こす可能性が示されている。
ADでは、ROSの過剰産生によって酸化ストレスが生じ、これがシナプス機能障害や認知機能低下に悪影響を与える。ADRDと関連するウイルス感染は細胞内でのROS産生を誘導し、これらの神経疾患の病態形成に関与している可能性がある。
活性酸素種(ROS)
ROSは、酸素を含む高反応性分子の広範なクラスのこと。
酸化ストレスとは、ROSの産生と体内の抗酸化防御機構との不均衡状態を指す。この不均衡はROSの過剰産生、あるいは抗酸化応答の不足によって生じる。ROSはタンパク質、脂質、DNA、小分子を損傷し、細胞機能の障害を引き起こす。一方で生理的条件下では、ROSは生体機能を調節するシグナル分子としても機能する。
ROSの主な産生源は、電子が酸素に移動する非酵素的電子移動反応。ミトコンドリアは体内で最も多くの細胞内ROSを産生する細胞小器官で、全細胞内ROSの約90%を占める。ミトコンドリア以外では、細胞膜や他の細胞小器官に存在する酵素によって全ROSの約10%が産生される。最も反応性の高いROSはヒドロキシルラジカル(•OH)で、ほぼ全ての有機・無機分子と反応する。
多くの研究によって、酸化ストレス誘発性損傷が加齢の主因であり、その結果として神経変性疾患発症に大きく影響することが示されている。酸化ストレス指標、抗酸化レベルの低下、様々なミトコンドリアDNAの変化は、高齢者の脳、軽度認知障害の患者、ダウン症、AD、およびADのトランスジェニック動物モデルにおいて観察されている。脂質、DNA、RNA由来の酸化損傷産物や糖化最終産物が、AD患者の血液、血漿、血清、脳脊髄液、尿、唾液中で検出されており、神経変性およびADのバイオマーカーと考えられている。
脳、特に神経細胞は、酸化ストレスおよび酸化損傷の蓄積に対して非常に脆弱で、これは主に脳が高い酸素消費量を有し、特に電子伝達系(ETC)複合体IにおいてROS産生が増加するためと考えられる。神経細胞膜は多価不飽和脂肪酸に富んでおり、脂質過酸化を受けやすい。脳の高い代謝活性も、ミトコンドリア由来ROS産生増加に寄与する。脳組織には特に鉄をはじめとする金属が多く含まれており、これがフェントン反応を介してROS生成を促進する。一方で、脳は他の臓器と比較して抗酸化酵素と酸化促進酵素の比率が低い。この不均衡が酸化損傷を増大させる。
タンパク質凝集とその拡散は、家族性および孤発性ADのいずれにおいても重要な特徴。この凝集過程は過剰ROS産生を引き起こし、酸化ストレスと重要な高分子の損傷をもたらす。さらにROSはミトコンドリア機能障害、神経炎症、血液脳関門の破綻に関与してAD進行を加速させる。
ADやパーキンソン病、脳卒中は、神経細胞における慢性または急性酸化DNA損傷の修復不全と関連している。DNA損傷は代謝によって時間とともに自然に蓄積するが、急性ストレスは急速な酸化障害を引き起こす可能性がある。高代謝率を有する脳細胞は、DNAおよびdNTPプールの完全性を維持するために、効率的なDNA修復機構に大きく依存している。分裂後で最終分化した神経細胞は、複製に関連したDNA損傷の検出および修復機構が乏しく、その結果、脳の遺伝的安定性は主に塩基除去修復機構に依存している。研究によると、神経細胞は複製関連DNA修復よりも、非相同末端結合のようなエラーを起こしやすいDNA修復経路に依存している。塩基除去修復に関与する抗酸化酵素が欠乏すると、酸化DNA損傷が蓄積し、長期的な神経機能障害につながる。
酸化損傷はAD進行に寄与するだけでなく、臨床症状が出現する前の早期段階から認められ、この事実はADの病態形成における酸化ストレス仮説を支持している。酸化ストレス仮説は、血管性認知症を含む他の神経変性疾患にも拡張されており、血管性認知症では虚血発作の初期または直後に酸化損傷が生じるため、ROSが発症および進行においてより重要な役割を果たす可能性がある。
ウイルス感染とADRDとの関係
1991年、AD患者の脳内で単純ヘルペスウイルス1型(HSV-1)のDNAが同定された。過去30年間にわたって、ヘルペスウイルス、HIV、フラビウイルス、ボルナ病ウイルス、肝炎ウイルス、インフルエンザAウイルス、SARS-CoV-2など多くのウイルスがADリスクの上昇と関連付けられてきたが、これらのウイルスの多くがADの病態生理にどのように関与しているかについての研究はいまだ限られている。
単純ヘルペスウイルスとADRD
ウイルスとADRDとの潜在的関連性は、慢性感染が神経炎症や脳内の病理変化を誘発または悪化させる可能性があるという考えに基づいている。この文脈で最も研究されているウイルスは、単純ヘルペスウイルス1型(HSV-1)やヒトヘルペスウイルス6(HHV-6)などのヘルペスウイルス。
ヒトサイトメガロウイルス(CMV)、HSV-1、水痘・帯状疱疹ウイルス(VZV)、HHV-6、ヒトヘルペスウイルス7(HHV-7)、カポジ肉腫関連ヘルペスウイルス、エプスタイン・バーウイルス(EBV)を含むヘルペスウイルス科ウイルスは、ROS、Aβ形成、神経細胞死、グリオジェネシス、オートファジーといった、神経変性疾患に共通する主要な病理過程に影響を与えるウイルス– 宿主間のタンパク質相互作用を介して、細胞恒常性の破綻や機能障害、ミクログリア機能の変化を引き起こし、ADに寄与する可能性が示されている。
潜伏HSV-1再活性化といったウイルス再活性はAβ産生の増加と関連している。抗菌防御仮説によると、Aβは自然免疫の一部として機能し、ウイルスを含む病原体に結合して中和する能力を有すると考えられている。この仮説を支持するように、Aβオリゴマーはヘルペスウイルスをアミロイドプラーク内に捕捉し、神経組織内での拡散を防ぐ。また、Aβがin vitroおよびin vivoの両方でHSV-1粒子の周囲に迅速に線維化し、感染トランスジェニックマウスの脳内でウイルスをアミロイドプラーク内に封じ込めることも示されている。同様に、ヒトAD脳の剖検解析では、HSV-1DNAとアミロイドプラークの共局在が認められており、潜伏ヘルペスウイルスの再活性化がアミロイド沈着に関与する可能性が示唆されている。
さらに、AD脳においてヒトヘルペスウイルス6A(HHV-6A)およびHHV-7の増加と、アミロイド前駆体タンパク質処理関連遺伝子の発現変化が報告されている。
これらの知見はAβが抗菌ペプチドとして機能し、凝集を通じてヘルペスウイルスなどの病原体を捕捉する可能性を支持している。この防御機構は感染拡大を抑制する一方で、アミロイドプラークの蓄積を促進し、結果としてADの病態形成に結びつく可能性がある。すなわち、防御機構が長期的には不適応となり、プラーク蓄積と神経毒性に寄与するということだ。
HSV-1とは対照的に、水痘・帯状疱疹ウイルス(VZV)はAD病理に直接関与しないとされてきた。しかし、in vitroモデルでヒトiPS由来神経幹細胞にHSV-1を24時間感染させ、その後100μMのバラシクロビルで24時間処理する二段階プロトコルによりHSV-1の休止状態が誘導され、この抗ウイルス処理により感染性子孫ウイルスの産生が抑制され、潜伏関連転写産物の発現が誘導され、潜伏様状態の成立が確認された。バラシクロビルはHSV-1の活発な複製を防ぎ、Aβ蓄積も抑制したが、その後これらの休止状態の培養細胞にVZVを感染させるとHSV-1の再活性化が起こり、HSV-1遺伝子発現の増加、Aβ沈着の増強、神経突起の退縮や細胞体縮小といった神経損傷の形態学的所見が、免疫染色および蛍光染色により確認されている。
重要な点として、バラシクロビルやアシクロビルなどの抗ヘルペス薬による治療は、認知症リスクの大幅な低下と関連しており、ウイルス再活性化やそれに伴う神経炎症が神経変性に寄与し、抗ウイルス治療が保護的に作用する可能性が示唆されている。
水痘・帯状疱疹ウイルス(VZV)とADRD
VZV(ヒトヘルペスウイルス3型)は最も一般的なウイルスで、水痘と帯状疱疹を引き起こす。初感染は主に幼児期に水痘として発症する。水痘初感染後、VZVは後根神経節に潜伏し、神経細胞内で休眠状態となる。加齢に伴う再活性化により帯状疱疹が発症し、急性神経炎や帯状疱疹後神経痛を引き起こす。急性神経炎は若年小児を除き多くの局所性帯状疱疹患者に生じ、帯状疱疹後神経痛は年齢により最大50%の成人に発症する。
3,326,673人を対象とした9研究を含むメタ解析では、VZV感染が認知症発症リスクの増加と関連していることが示されている。帯状疱疹のような神経指向性ウイルスが認知症に関与する機序として、神経炎症、脳血管障害、直接的神経損傷などが提唱されてされている。
VZV再活性化と認知症リスクの関連は、特に眼部帯状疱疹などの脳神経障害や中枢神経系病変を伴う場合に顕著。VZVは脳神経節や中枢神経系組織に親和性を示すため、これらの病型では神経炎症や神経変性後遺症のリスクが高い。
脳神経または中枢神経系に病変を有する患者で、他部位の帯状疱疹よりもADとの関連が強いことを報告する研究もある。これは、脳内または脳近傍での局所的ウイルス再活性化が、神経損傷、炎症、タンパク質誤折り畳みを悪化させる可能性を示唆している。これらの知見は、眼部あるいは神経侵襲性帯状疱疹を、長期的な認知機能リスクを考慮すべき重要なサブタイプとして認識する必要性を示している。
VZV感染ヒト脳血管外膜線維芽細胞の遺伝子発現解析では、血管リモデリングや血管疾患に関連する経路の有意な活性化が認められた。RNAシーケンスでは、アミロイドーシス、糖尿病、ADに関与する遺伝子セットの顕著な上方制御が確認された。上流制御因子として、アミロイド前駆体タンパク質、アポリポタンパクE、タウ、プレセニリン1、アミリンなどが同定されている。感染3日後には、免疫蛍光染色によりVZV糖タンパクの存在と、Aβ42およびアミリンの検出が確認され、Thioflavin T染色によりβシートに富むアミロイド線維構造が可視化された。
非感染細胞ではこれらは認められなかった。
追跡研究では、マトリックスメタロプロテアーゼ3および10の分泌増加や、感染培養上清で処理した細胞の遊走亢進が示された。これらの所見は、脳血管壁の脆弱化、炎症亢進、血管性認知症やAD様病理への関与を示唆している。
症候性HSVまたはVZV感染と認知症リスク、ならびに抗ウイルス治療の保護効果を検討したスウェーデンの大規模レジストリコホート研究では、50歳以上26万人超を追跡した結果、抗ウイルス治療を受けていないヘルペス感染は認知症リスク増加と関連し、バラシクロビルなどの治療はリスク低下と関連していた。ヘルペスと診断された患者のうち、治療を受けた群では未治療群に比べて認知症リスクが25%低かった。
サイトメガロウイルス(CMV)とADRD
CMV(ヒトヘルペスウイルス5型)は、高齢者における慢性的な免疫活性化やウイルス再活性化を通じて、アルツハイマー病(AD)の病態形成に寄与する可能性がある。
CMVは生涯にわたる潜伏感染を成立させる持続性のβヘルペスウイルスであり、特に免疫老化が進んだ宿主では周期的に再活性化することがある。初感染時に症状を示すのは全体の約10%に過ぎず、主に年長児や成人でみられ、残りの90%は無症候性である。
近年の研究で、CMV感染者においてCD4+CD28−/CD57+T細胞の増加が認められており、これらがアミロイドβ(Aβ)の蓄積に寄与する可能性が示されている。これらの老化CD4+T細胞は増殖能は低いものの、細胞傷害活性を保持し、高レベルの炎症性サイトカインを分泌する。この結果、ADの既知の危険因子である持続的な低度炎症環境が形成される。
SARS-CoV-2とADRD
世界的な影響の大きさから、SARS-CoV-2はウイルス誘発性神経変性研究の主要な焦点となっている。
コロナウイルスはプラス鎖一本鎖RNAウイルスで、一般的には風邪の原因となる。しかし、COVID-19パンデミックを引き起こしたSARS-CoV-2のように致死的な株も存在する。
SARS-CoV-2はアンジオテンシン変換酵素2(ACE2)を受容体として宿主細胞に侵入する。ACE2は心血管および神経病理における主要なメディエーターであるアンジオテンシンIIを分解する酵素で、ウイルスとの相互作用はCOVID-19患者における合併症と関連する。これらの相互作用は血管機能障害を悪化させ、神経炎症カスケードを促進する可能性があり、これはCOVID-19とADの進行において双方に共通する中心的プロセス。
COVID-19の死亡率低下を目的として呼吸器および心血管系への対応が重視されてきた一方で、神経学的症状も多く報告されている。中国・武漢で入院した214名の患者を後ろ向きに解析した結果、約36%に神経症状が認められた。これには頭痛、めまい、意識障害、運動失調、痙攣、認知障害、脳炎、急性脳血管障害、虚血性脳卒中などの中枢神経系症状が含まれた。末梢神経系障害も多く、脳神経多発神経炎、ギラン・バレー症候群、神経痛、神経眼科的障害、神経筋接合部障害、感音性難聴、骨格筋障害が報告されている。
さらに、UKバイオバンクによる785名(51~81歳)の画像研究では、軽症COVID-19であっても眼窩前頭皮質や海馬傍回など、嗅覚や記憶に重要な領域の灰白質減少が認められた。一次嗅覚皮質と機能的に関連する領域に広範な組織障害がみられ、脳全体の萎縮増加および認知機能低下も確認された。これらの変化は入院歴などを調整後も持続しており、軽症感染であっても長期的な神経解剖学的変化が生じうることを示している。
これらの変化は初期ADで影響を受ける脳領域と一致しており、嗅覚障害、炎症反応、血管およびグリア支持系の破綻を介して、SARS-CoV-2が神経変性過程を開始または加速させる可能性を支持している。
重症COVID-19患者では神経合併症発症率が有意に高い。これは重症例に特徴的なサイトカインストームによる炎症性・神経毒性作用によって支持されている。中枢神経系への影響は、ADを含む基礎的な神経変性疾患を誘発または悪化させる可能性がある。既存の認知障害のない入院COVID-19患者と、正常認知、軽度認知障害、ADの非COVID対照群を比較した結果、COVID-19患者で総タウ、リン酸化タウ181、GFAP、NfLなどの神経変性バイオマーカーが有意に上昇していることがわかっている。特に脳症を呈した患者や死亡例で顕著で、非COVIDのAD患者よりも高値だった。これらの変化は重症度や転帰と強く相関しており、SARS-CoV-2が神経・グリア障害を引き起こす可能性を示している。
SARS-CoV-2は脳内のアストロサイトにも感染して神経細胞の可塑性を障害し、認知障害につながることも示されている。
認知症は重症COVID-19のリスクを約3倍高め、死亡率も約30%高いと報告されており、免疫低下や併存疾患、既存の中枢神経脆弱性が重症化と回復不良の要因となる。
疫学研究でも、SARS-CoV-2感染がAD発症リスクを高める可能性が示唆されている。COVID-19患者の脳でAD様分子異常が認められることが報告され、長期的な神経変性リスクを示唆している。血液脳関門破綻やAPOE ε4遺伝子型も重症化およびAD進行と関連している。
15万人超の大規模コホート研究では、COVID-19感染後1年以内に新規AD発症リスクが約2倍、記憶障害が77%増加していた。軽症例でも同様のリスクが認められ、COVID-19生存者の約7%が初期AD様の持続的神経症状を呈すると結論づけている。
エンテロウイルスとADRD
エンテロウイルス属は、10種の真正エンテロウイルスと3種のライノウイルスに分類され、一般的な風邪から、ポリオや無菌性髄膜炎といった重篤な疾患まで幅広い病気の原因となる。エンテロウイルス71は、手足口病との関連や重篤な神経合併症を引き起こす可能性から、特にアジアにおいて公衆衛生上の重要な問題となっている。脳幹が主な感染部位で、乳幼児では重篤な臨床転帰や長期的な精神心理学的障害を引き起こす例もある。
複数の研究では、エンテロウイルス感染がトール様受容体(TLR)の活性化を介してADを含む神経変性と関連する可能性が示唆されている。TLRは炎症反応を開始し、神経変性を含むさまざまな病的状態に関与する。TLRと関連する小胞体ストレス応答(unfolded protein response)や酸化ストレスは、神経変性疾患で共通して観察される特徴。エンテロウイルス71感染は、TLR7経路を介して脳内の病態形成を引き起こし、ヒトおよび動物モデルの双方において神経変性に寄与する。
エンテロウイルスD68感染は、急性弛緩性脊髄炎、脳神経障害、脳炎、髄膜脳炎など、複数の神経学的合併症と関連している。これらの合併症は、発熱、咳嗽、鼻漏、咽頭炎などの呼吸器症状や、嘔吐や下痢といった消化器症状に続いて発症することが多い。一部のエンテロウイルスD68症例では、四肢麻痺を伴わない脳神経障害が観察されている。
脳神経運動核は、顔面、口腔、呼吸器、舌などの筋肉を支配しており、これらの機能障害は多様な運動性神経症状を引き起こす。エンテロウイルスD68は運動ニューロンへの嗜性を有するため、脳神経ニューロンに直接感染、あるいは脊髄前角運動ニューロン感染と同様の機序で中枢神経系に侵入する可能性がある。また、脳脊髄液中でエンテロウイルスD68が検出されており、血液脳関門を越えて中枢神経系に到達して神経合併症に寄与する可能性が示唆されている。
HIVとADR
抗レトロウイルス療法の進歩によってHIV感染者の平均余命は大きく延長されたが、その結果、HIV集団において非感染性疾患の発症が増加している。HIV関連神経認知障害は、HIV感染者の30~60%に影響するとされている。HIV関連合併症は多因子的だが、ウイルスから放出されるgp120は神経細胞および血管内皮細胞の障害に関連する。これらの細胞障害は脳卒中を引き起こし、その結果として血管性認知症につながる可能性がある。
HIVは高血圧と並んで脳卒中の危険因子で、HIV感染者では非感染者より脳卒中発症率が高い。血管系危険因子は、HIV関連認知症および認知機能低下の発症において重要な役割を果たしている。
HIVのヌクレオシド系逆転写酵素阻害薬であるラミブジン(3TC)を、ADが疑われる軽度認知障害患者に24週間投与したパイロット試験では、本薬が実行可能で安全であり、脳脊髄液への移行性を有することが示された。認知機能は安定していた一方で、探索的バイオマーカー解析では、脳脊髄液中のグリア線維性酸性タンパク質(神経炎症マーカー)の低下や、血漿Aβ42/40比の上昇(アミロイド負荷低下を示唆)が認められている。この結果は、ヌクレオシド系逆転写酵素阻害薬をADRDに対する疾患修飾療法として使用する根拠を支持する。
HSV-1およびHSV-2による細胞内ROS産生
HSV-1感染におけるROS産生を直接観察した最初の報告は07年に発表された。レチノイン酸で分化させた神経様P19胚性癌細胞にHSV-1を感染させると細胞内ROSが増加し、脂質過酸化の副産物が培養上清中に放出されることが示された。HSV-1KOS株接種後1、2、3、24時間でヒドロキシフェニルフルオレセイン(•OHにより酸化されて蛍光を発する)を用いてROSを測定したところ、ROSレベルは対照と比較してそれぞれ21.5%、69.8%、45.7%、80%有意に上昇していた。
熱または紫外線で不活化したHSV-1ではROS産生は認められなかった。
HSV-1脳炎のマウスモデルでは酸化ストレスマーカーが検出され、ビタミンE欠乏が病態を悪化させることが示された。野生型C57BL/6マウス由来の培養ミクログリア細胞では、HSV-1によるROS産生および酸化障害がTLR-2欠損マウス由来細胞で低下していた。2005年には、HSV-2糖タンパク質G由来ペプチドが、ヒト好中球および単球において食細胞NADPHオキシダーゼを介してスーパーオキシド(•O₂⁻)産生を促進することが示されている。
2011年の研究では、抗酸化物質N-アセチルシステインおよびピロリジンジチオカルバメートは、マウスマクロファージにおけるHSV-2誘導性サイトカイン発現を抑制した。また、Mori ramulus、インド原産植物Embelia ribesの果実由来エンベリン、栗蜂蜜、Maackia amurensis心材由来ポリフェノールなどの天然抗酸化物質が、抗酸化作用を介してHSV-1からの保護効果を示している。
VZVによる細胞内ROS産生
初期in vitro研究では、多形核白血球をVZVで処理するとH₂O₂産生が有意に増加し、ウイルスによるROS産生が示されている帯状疱疹患者43例と年齢を一致させた健常対照47例を対象とした症例対照研究では、帯状疱疹患者では総酸化状態および酸化ストレス指数が有意に上昇し、総抗酸化能および総ポリフェノール量が低下していることがわかっている。この結果は、VZV感染がレドックス恒常性を破綻させ、過剰なROS蓄積を特徴とする酸化優位な細胞環境をもたらすことを示している。
CMVによる細胞内ROS産生
ヒト冠動脈平滑筋細胞にCMVを感染させると細胞内ROSが産生され、NF-κB転写因子が活性化されることがわかっている。N-アセチルシステインがNF-κB活性化を抑制したことから、ROSがCMVの宿主細胞への作用に関与する思われる。さらに、エストロゲンが抗酸化作用を有し、CMVの影響を打ち消すことも報告されている。
コロナウイルスによる細胞内ROS産生
パンデミック以降、コロナウイルスがROS産生を促進する能力について詳細に研究されてきた。コロナウイルスは、NADPHオキシダーゼやキサンチンオキシダーゼなどのROS産生酵素を活性化する一方で、抗酸化防御機構を弱体化させることがわかっている。
SARS-CoV-1の非構造タンパク質および付加タンパク質が細胞内ROS蓄積を誘導し、SARS-CoV-1のパパイン様プロテアーゼがヒト肺上皮A549細胞においてROS産生を誘導してp38 MAPKおよびSTAT3経路を活性化してEgr-1発現およびTGF-βなどの線維化関連遺伝子発現を増加させることがわかっている。これらの作用はROS阻害剤により抑制されている。
SARS-CoV-2では、血中に大量の遊離S1スパイクタンパク質が存在することが示されており、これが脳に有害な影響を及ぼす可能性がある。過去の研究では、ヒトミクログリアや網膜色素上皮細胞などで、スパイクタンパク質がROS産生、細胞老化、炎症を誘導することが報告されている。
スパイクタンパク質曝露がヒト内皮細胞(TMNK-1、EAhy926)および上皮細胞(A548、Huh7.5)に与える影響をROS検討した研究では、スパイクタンパク質は両細胞種においてROSレベルを上昇させ、老化マーカーを活性化している。また、インターロイキン6 や HMGB1などの炎症性分子を放出する老化関連分泌表現型も誘発している。さらに、スパイクタンパク質を発現する上皮細胞由来の条件培養では内皮細胞における傍分泌性老化を誘導し、血管細胞接着分子1や細胞内接着分子発現を上昇させることで白血球接着を増加させた。これらの作用は、インターロイキン6シグナル阻害剤(トシリズマブなど)や炎症経路阻害剤(ザヌブルチニブなど)によって軽減された。
コエンザイムQ10はコロナウイルス誘発ROSレベルを有意に低下させ、抗酸化防御機構を回復させたことから、COVID-19に関連する血栓性合併症に対する治療的役割が示唆されている。
SARS-CoV-2スパイクタンパク質はACE2の発現低下を引き起こし、血管作動性ペプチドであるアンジオテンシンIIが制御不能に蓄積する。アンジオテンシンIIは血管収縮、炎症、組織線維化を促進するとともに、細胞内ROS産生を刺激する。これらは疾患の発症・進行および老化過程における重要因子。
さらに、ROSがウイルス侵入および病態形成に関与することを支持する研究も存在する。
過剰な鉄が感染細胞内でROS産生を増加させることでSARS-CoV-2の重症化を悪化させることが示されている。同様に、SODがROS調節を介してSARS-CoV-2誘発性形質細胞アポトーシスから形質細胞を保護することが報告されている。。
・・・AD家族歴がある方、上記ウイルス感染症歴があるかた、ADリスクと関連する確率がたかいとされる血中コレステロール値が高い方は、文中の阻害剤を試用することも検討されてはいかがでしょうか。
ROSへの栄養学的対処方は後日改めてまとめたいと思います。