
・・・またまた長文になってしまった。
テーマは加齢による筋量低下と身体機能の低下。
ブログで公開するか一瞬迷ったものの、しかし、加齢による身体機能の低下やメンタルヘルスの改善のために当院に通い始めた皆様がご自身の体の現状や、トレーニングや栄養指導による改善プロセスを少しでも具体的にイメージできるのに役立ってくれれば・・そんな思いでデータをまとめてみた。
具体的にイメージしながらトレーニングした方が良い結果につながるでしょう。
加齢は遺伝的背景によって決定され、様々な環境要因の影響を受ける
私はどちらかというと遺伝よりも環境や食事などの外部要因の影響が強いと思っている。
加齢による有害な影響を体の全構造が受ける際、最も目に見える変化は骨格筋、体脂肪、骨組織に現れるというのが現在のコンセンサスだ。
体重の減少は50歳を過ぎから顕著になり、加齢とともにさらに加速する。成人した健康なヒトにおける筋量は約42%、高齢者では約27%に減少する。
この加齢による筋肉量の減少状態はサルコペニアと呼ばれ、特に60歳以降のサルコペニアは体脂肪の大幅な増加(サルコペニア性肥満)を伴うケースがある。
サルコペニアは人間の運動能力を低下させ、加齢に伴う他の多臓器不全の速度を加速させるため人体にとって特に有害とみなされている。
現在のサルコペニアの定義は以前の定義と異なり、単に筋量減少だけではなく筋力低下と機能的障害により注目を当てている。
サルコペニアでは主に速筋のII型線維が萎縮する。
筋量と筋力は加齢とともに減少するが、筋力の減少は筋量の減少のみから予測されるより2~5倍速いとの報告もある。
筋肉は運動機能に加え、代謝のホメオスタシスにも不可欠で、サルコペニアはインスリン抵抗性、糖尿病、心血管疾患のリスクを高める。
筋肉や骨組織と異なり、体脂肪は加齢とともに増加する。
その後、超高齢期になって初めて脂肪組織は減少する。
しかし、加齢による重大な変化は脂肪組織の顕著な再分配で、皮下脂肪組織(SAT)の減少は内臓肥満の増加と、骨髄、肝臓、特に骨格筋(ミオステアトーシス)などの異なるデポにおける脂肪細胞および脂質の蓄積を伴う。
サルコペニアの発症を抑制し、健康的な加齢を維持するには適切な栄養摂取が不可欠であるが、高齢者ではいわゆる加齢性食欲不振が観察される。
この現象は、食欲不振、味覚の変化、消化管の変化などが要因となる。
タンパク質やカロリー消費量が減少し、筋タンパク質合成が低下する一方、カロリーの過剰摂取による肥満もサルコペニアの発症に寄与することもある。
サルコペニア肥満(SO)は除脂肪体重の減少に伴い、脂肪組織、特に内臓脂肪が過剰に蓄積することで発症する。
SOリスクと発生率は、年齢とともに増加する。
肥満とサルコペニアの両方は代謝プロセスに影響を与える亜急性の慢性炎症性状態(低悪性度炎症)により特徴付けられ、脂肪組織と骨格筋組織の両方の機能を崩壊させる。したがって、サルコペニア肥満は、肥満やサルコペニア単独よりもはるかに深刻な健康被害を引き起こす可能性がある。
肥満とサルコペニアの共存は筋肉量と機能低下を加速させ、総合的な身体能力を低下させ、死亡リスクを増加させる。肥満と加齢の両方が骨格筋や他の臓器に脂肪組織の異所性沈着を助長する。
さらに筋機能障害に加えて、酸化ストレス、炎症、ミトコンドリア機能障害、インスリン抵抗性といった他の障害の一因となる。
近年、筋肉と骨の健康状態の悪化における過度の肥満を強調するために、「骨粗しょう症性肥満」という用語が提唱されていることは注目に値するだろう。
リンクのレビューは、サルコペニアの一連のプロセスにおける細菌叢やマイオカインなど様々な因子の役割に関する現在の知見をまとめている。
また、肥満患者における筋力低下の潜在的な経路について議論している。
Multifactorial Mechanism of Sarcopenia and Sarcopenic Obesity. Role of Physical Exercise, Microbiota and Myokines
・サルコペニアおよびSOにおける骨格筋の変化に関する病理学的機序
サルコペニアは、運動ニューロンの喪失に伴う神経学的要因、筋運動の喪失、内分泌の変化、座りがちな生活様式や栄養不良などの複合的な要因によって引き起こされる。
高齢者におけるサルコペニアの発症には、ホルモンやサイトカインの不均衡、加齢に伴う全身性炎症、腸内細菌叢の異常、微小循環障害、代謝障害、主に肥満とインスリン抵抗性を含むいくつかの要因が影響する。また、運動不足や量的・質的栄養失調もこのプロセスに寄与する。
これら全ての因子は骨格筋上で複雑に相互作用し、骨格筋成長因子の発現を減少させ、酸化ストレスを増加させ、ユビキチン-プロテアソーム系とオートファジーの活性を増加させる。
これらのメカニズムは筋タンパク質合成と分解のバランスを崩し、衛星細胞の数と機能の低下、ミトコンドリアの機能不全を引き起こし、最終的に骨格筋の萎縮と機能不全を引き起こす。
骨格筋量と機能維持は多面的で、加齢、疾患と損傷、運動と食事など複雑な調節過程に依存している。
筋合成プロセス、特に衛星筋細胞の活性化と筋芽細胞の増殖、筋芽細胞の細胞周期からの離脱、その後の多核筋繊維への分化と融合も重要である。
また、筋組織の修復と再構築のプロセスや筋タンパク質の分解と合成バランスも調節因子に含まれる。
インスリン様成長因子1(IGF1)などの成長因子と細胞内成分のカスケードを含むシグナル伝達系は、骨格筋の成長を制御する上で重要な役割を担っている。
筋タンパク質合成の増加と肥大化にはリボソーム活性の増加が必要であり、これはリボソーム効率の増加(すなわち、リボソームへのmRNAの翻訳量の増加)および(リボソーム生合成による)リボソーム容量の増加によって実現されるmTORC1活性がに両方のプロセスを制御しているが、サルコペニアの筋肉では、この経路が損なわれており、サルコペニアの発症に関与している。
筋幹細胞は衛星細胞とも呼ばれ、筋繊維の再生、修復、筋肥大に重要な役割を担っている。
衛星細胞は筋繊維の基底膜の下に存在し、筋線維が傷害される(この表現は?刺激されると?)と休眠状態の衛星細胞が活性化され、筋芽細胞への増殖と分化が起こる。
加齢に伴い衛星筋細胞、特にII型は明らかに減少し、その機能は損なわれ、修復されない筋細胞の蓄積をもたらす。
身体の各器官のサイズが正確に制御されているメカニズムは依然として複雑な生物学的問題となっている。
ヒッポ経路は、すべての真核細胞の成長過程、部分的な細胞周期、アポトーシスを制御する役割を担っている。このユニークな経路は、多くの表面受容体からのシグナルと他の内部分子シグナルを統合して、再生と細胞分裂のプロセスを管理する。
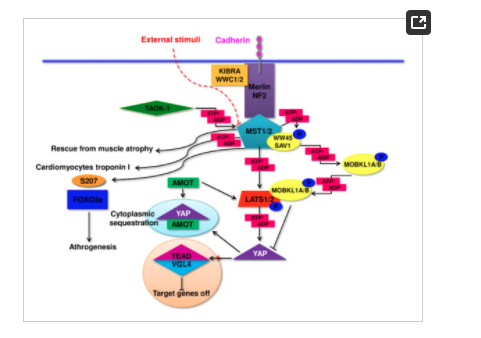
筋細胞においてHippoとmTORが協調し、筋肥大時にHippoが筋繊維の遺伝子転写を制御し、mTORが翻訳とタンパク質合成の増加に関与している可能性を示唆した研究もある。
しかし、筋形成とサルコペニアへの関与に関しては相反する多くの研究結果があり、これらのプロセスにおけるその役割を明確に決定することはできない。
サルコペニアのメカニズムはまだ完全には解明されていないが慢性炎症と免疫障害が重要視されており、加齢に関連した免疫系悪化の総体を説明するために、免疫老化という概念が用いられている。
加齢の過程で免疫細胞の分泌プロファイルが変化して炎症性サイトカインの放出が増加し、「感染のない状態で起こる炎症(sterile inflammation)」を発症し、組織障害を引き起こす。
炎症性サイトカインはユビキチン-プロテアーゼ系を活性化することにより、サルコペニアの発症に寄与している可能性がある。
また、インスリン成長因子-1(IGF-1)の同化促進作用に拮抗する可能性もある。
炎症は同化抵抗性の原因となり、高齢者における生理的刺激に応じた骨格筋タンパク質合成が不十分になるという事実にも関与している可能性がある。
肥満や加齢に伴う慢性的な低悪性度炎症は、インスリン抵抗性(IR)と同化抵抗性(AR)の同時発生に影響を与える可能性がある。
後者は食事性タンパク質や身体活動などの同化刺激に対する骨格筋タンパク質合成の障害である。
IRとARが同時に起こると相乗的に作用し、2型糖尿病(T2D)および骨粗しょう症性肥満の発症に寄与する可能性がある。
低悪性度の全身性炎症と筋肉内脂肪浸潤の両方が、ミトコンドリア機能障害とミオカイン放出障害を引き起こす可能性がある。
免疫細胞と骨格筋の相互作用は骨格筋の再生に不可欠であるため、免疫低下が骨格筋再生に影響を与えることは明らか。筋損傷時、免疫細胞は骨格筋に浸潤して壊死細胞を除去し、衛星細胞の増殖と分化に影響を与える成長因子を分泌する。加齢に伴う免疫老化の過程でこれらの細胞の正常な機能が失われ、骨格筋の再生が損なわれる。
高齢のマウスの実験では、骨格筋の再生に必要なCD4+ CD25+ Foxp3+制御性T(Treg)細胞が枯渇している。
高齢者における免疫機能の低下はディスバイオシスとも関連している。
加齢に伴うディスバイオシスと加齢に伴う全身性炎症の直接的な関連性は、高齢マウスにおいて腸管透過性と血中炎症性サイトカインが増加し、加齢に伴う炎症が引き起こされるという研究で報告されている。
微生物は皮膚、膣、気道、口腔など、上皮で覆われたすべての表面にコロニーを形成し、下部消化管は常在微生物の密度および多様性が最も高い。これらの細菌には、細菌、古細菌、真菌、ウイルス、原生動物が含まれる。
胎盤、乳房、子宮、卵管、さらには精液など、以前は無菌とされていた部位からも微生物叢が分離されている。
高齢者では腸内細菌叢が不安定になり、多様性が低下する。
これは、虚弱体質の増加や免疫系の悪化と関連している。
高齢者において観察される腸内細菌叢の多様性の低下は疾病および死亡率の予測因子である一方、アッケルマンシアおよびビフィドバクテリウムなどの特定の細菌の豊かさは長寿と関連していると考えられている。
加齢に伴う酪酸産生菌(クロスロリジウム クラスター XIVa and IV)の減少は、プロテオバクテリアや、ルミノコッカス、フソバクテリウム、パラバクテロイデスなど、健康な成人では存在量の少ない日和見細菌の拡大を伴う。
加齢に伴うディスバイオーシス、ムチン層の菲薄化および上皮の隙間の増大は粘膜バリアの透過性を増大させ、これにより微生物および微生物産生物の体内循環への移行が可能となる。
動物実験では、微生物および微生物産生物の腸管内腔から循環系への移行が、ヒトの多くの加齢関連疾患に関与する全身性炎症および免疫系調節不全の重要な要因であることが示唆されている。
加齢に伴うディスバイオーシスは炎症だけでなく同化抵抗も促進し、最終的に筋肉サイズの縮小、筋肉機能の低下、有害な臨床転帰を条件付ける可能性がある。
多くの動物実験により、腸内細菌叢が骨格筋機能を制御できることが示されている。すべての微生物を取り除いたマウスは筋肉量が少なく、筋繊維が少ない一方で、筋萎縮マーカーは特定の病原体を含まないマウスと比較して上昇していることは注目に値する。観察された変化は、糞便微生物叢移植(FMT)およびSCFA補給後に逆転した。
他の動物実験では、フェカリス・プラウスニッツィの補給が対照群と比較して筋肉量を増加させることを示している。
近年、プロバイオティクスは運動後のパフォーマンスの向上と疲労軽減のため、アスリートに使用されている。
マウスを用いた動物実験では、ラクトバチルス・サリバリウスを4週間補給することで筋力と持久力が著しく向上し、肝臓と筋肉のグリコーゲン貯蔵量が増加することが示されている。
重量挙げの金メダルチャンピオンから分離したビフィドバクテリウム・ロンガムをマウスに移植すると、肝臓と筋肉のグリコーゲン貯蔵量とともに筋力と持久力を増加させた研究もある。
さらに、乳酸菌の補給は健康な人の運動パフォーマンスを向上させると同時に筋肉量を有意に増加させ、がん患者の筋肉損失を有意に減少させることが示す研究もある。
プレバイオティクス(イヌリンおよびトランスガラクトオリゴ糖)の使用は高齢者の筋力と持久力を増加させたことから、プレバイオティクスが筋肉機能に有益な影響を与えるとする研究もある。
プレバイオティクスの補給でビフィズス菌と酪酸産生菌が増加し、それによって高齢者の筋肉量と機能が改善することが示唆されている。
腸内細菌叢とプレバイオティクスが筋肉機能に関与する可能性は、抗生物質投与によってエネルギー産生にグリコーゲンを使用する能力が低下するため、マウスの運動耐久性が著しく低下することを示す実験によって裏付けられている。
急性白血病のマウスモデルに特定の乳酸菌を経口補給することによってサルコペニアが緩和される一方で、筋肉量と機能が増加した興味深い観察も存在する。
限られた数ではあるが、動物及びヒトの研究で身体的虚弱及びサルコペニアの病態生理に積極的に関与する腸-筋肉軸の存在を示唆している。
サルコペニアの発症にディスバイオーシスがどのように寄与しているかはまだ不明である。
・ディスバイオーシスが吸収・利用能の低下や加水分解の増加などタンパク質代謝に影響を与え、筋タンパク質合成の低下やサルコペニアの発症につながる可能性。
・ディスバイオーシスが、例えばリポ多糖(LPS)のような微生物の産生物の循環への移行を促進する腸のバリア機能不全に寄与し、全身性の低悪性度炎症とインスリン抵抗性を引き起こすことで最終的にサルコペニアにつながる 可能性。
・高齢者における腸バリアー漏出とディスバイオーシスが粘膜組織の免疫細胞を活性化し、それが患部である臓器、例えば末梢の筋肉に移動する可能性。
・ディスバイオーシスが免疫調節及び抗炎症性のSCFAsの産生を減少させ、サルコペニアの発症をサポートする可能性
・ディスバイオーシスによるSCFA産生の減少がインスリン抵抗性を促進し、ミトコンドリア脂肪酸酸化を減少させ、筋肉内脂肪酸沈着を促進し、筋力低下、インスリン抵抗性、およびサルコペニアにつながる可能性
が挙げられる。
腸内細菌叢が産生するフェノール化合物は筋肉細胞におけるグルコースの取り込みを増加させ、筋肉量を増加させる同化反応を促進する。
SCFAは筋ミトコンドリアに作用することから、骨格筋に対する腸内細菌叢の効果の推定されるメディエーターとみなされている。高齢者における腸内細菌叢の異常とSCFAsの産生低下は、サルコペニアの発症に寄与している可能性がある。
サルコペニアにおける炎症誘発因子は、ディスバイオーシス高齢者で生成された老化ミトコンドリアから酸化されたセルフリーmtDNAである可能性がある。酸化されたフリーmtDNAはダメージ関連分子パターン(DAMP)として自然免疫を活性化して炎症性メディエーターの合成を促進し、筋肉の消耗を助長する炎症を引き起こす可能性がある。
・肥満
脂肪組織は炎症性経路の活性化及び低悪性度の慢性炎症につながる。
すなわち、代謝性疾患、心血管系疾患、いくつかの癌の発症との関連している。
肥満の有病率は加齢とともに増加し、高齢化社会では肥満の蔓延が医療問題へと発展している。
哺乳類における脂肪組織は一様ではなく、余分なエネルギーを中性脂肪として蓄える白色脂肪組織(WAT)と、蓄えたエネルギーを熱として放散する褐色脂肪組織(BAT)に分かれる。
また、褐色脂肪細胞と白色脂肪細胞の両方の特徴を持つ新たな脂肪細胞が、皮下WATで前脂肪細胞の別のサブセットから発生することが近年の研究で新たに確認されている。
その外観と位置から、この脂肪細胞はブライト脂肪細胞またはベージュ脂肪細胞と呼ばれている。
WATには皮下脂肪組織(SAT)と内臓脂肪組織(VAT)の2つがあり、これらは異なる代謝および免疫学的プロフィールを示す。
VATとSATは共に、トリアシルグリセロールの形でエネルギーを貯蔵し、エネルギーのホメオスタシスと代謝を制御する内分泌器官として機能する。
また、VATは重要な内臓器官の保護膜を提供し、皮下WATは温度変動に対する断熱材となる。
BATの主な集積部は肩甲骨間深部にあり、肩甲骨下、頸部、腋窩に広がっている。
またBATは大動脈、傍脊椎および副腎にも存在する。
BATの主な機能は熱発生の仲介であると考えられている。
BATの活性は肥満およびインスリン抵抗性と逆相関している。
SATの蓄積とは対照的に、VATの蓄積は代謝性疾患および心血管疾患および早死のリスクの増加と関連する。
痩せた人では、VATは良好な血管形成、交代活性化(M2)脂肪組織マクロファージ(ATM)、Treg細胞、Th2細胞、好酸球などの調節・免疫抑制細胞の存在、抗炎症物質の分泌を特徴とする。
一方で肥満におけるVATの拡大は、脂肪細胞による多くの炎症性分子の分泌に関連した炎症性転換をもたらす。脂肪細胞は肥大化し、低酸素状態になり、死滅して自然免疫反応を引き起こす。肥大化した脂肪細胞は、アディポネクチンなどの抗炎症性アディポカインの産生が減少している。
脂肪組織には炎症性免疫細胞が浸潤してTreg細胞の数が減少しているため、炎症性メディエーターの産生がさらに増加する。肥満およびインスリン抵抗性のヒトおよび動物の骨格筋におけるYapレベルは、著しく低下する。
現在、肥満の発症には腸内細菌組成の変化が関係していることが認識されている。
腸管内腔に存在する細菌の主なグループには、ファーミキューテス(例:ラクトバチルス)およびバクテロイデット(例:バクテロイデス)が含まれる。
ディスバイオーシスは、炎症性腸疾患、セリアック病、関節リウマチ、1型糖尿病、多発性硬化症、アレルギー、肥満など多くの炎症性疾患や自己免疫疾患に関与している。
高脂肪食(HFD)で飼育された肥満患者やマウスでは腸管透過性の上昇が認められ、欧米食の直接的な影響や腸管バリア機能を維持するビフィズス菌などの消失などが観察された。
さらに、肥満者の大腸菌叢から分離された特定のエンテロバクターは、HFDを与えたマウスに炎症や腸管透過性の上昇を誘発することが知られている。
リポポリサッカライド(LPS)の血漿レベルの上昇は、腸内細菌叢の異常と腸管透過性の上昇の組み合わせが原因であると考えられている。
LPSレベルの上昇に加えて低レベルの細菌感染症がほとんどの肥満患者で認められ、T2Dを発症した個体ではそのレベルが上昇していた。
「痩せ型」の細菌叢を持つマウスと「肥満型」の細菌叢を持つマウスを同居させると、肥満の発症とメタボリックシンドロームを防ぐことができることから、痩せ型の表現型に関連する細菌種が肥満に関連する細菌よりも優位に立つと考えられる。
また、健康な除脂肪体重のドナーから肥満患者へのFMTはインスリン感受性を改善したとする研究もある。
・アディポカイン
白色(WAT)および褐色(BAT)脂肪組織は、エネルギー貯蔵や熱発生の役割に加え、内分泌器官である。WATおよびBATはそれぞれadipokineおよびbatokine、シグナル伝達型の脂質(リポカイン)およびエキソソームのマイクロRNA(miRNA)を分泌することで他の臓器とコミュニケーションをとり代謝を調節している。
特に白色脂肪組織は、adiponectin (APN)、 IL-1、 IL-6、 IL-8、 IFN-γ、TNF-αなどのadipokineを生産する。
アディポカインは代謝ホメオスタシスを制御し、免疫機能に影響を与える。
SO患者では炎症性アディポカインの血漿レベルが上昇しており、筋力と逆相関している。
またこれらの炎症性物質は筋肉の再生を抑制し、萎縮を促進するという報告もある。
レプチンは主に脂肪細胞で産生され、肥満と直接関係している。
レプチンは炎症性アディポカインであり、免疫反応を調節する上で重要な役割を担っている。
最近の研究で、高齢女性の血漿レプチン濃度はBMIと正の相関を示し、サルコペニアの指標である骨格筋指数(SMI)とは負の相関を示すことが判明した。この結果は、レプチンがSOの病態に関与している可能性があることを示している。
・筋骨格系
筋肉と骨の質量と機能は加齢とともに低下し、ともに脂肪組織の蓄積を伴う。
加齢以外では、肥満、運動不足、性ホルモンの欠乏、グルココルチコイドへの曝露により、両組織の脂肪蓄積は促進される。
脂肪は、筋肉内脂肪(IMC)として知られる筋繊維自体での蓄積だけでなく、筋間脂肪(IMAT)と呼ばれるように骨格筋束間や筋膜下にも蓄積される。
脂肪浸潤(筋萎縮)は、加齢に伴う筋機能低下に大きく関与する 。
IMATの増加は、骨格筋の収縮力とその代謝機能の低下をもたらす。
タイプI繊維(遅筋の酸化繊維)はタイプII繊維よりも加齢とともに多くの脂質を回収する。
骨格筋における脂肪組織の蓄積はII型繊維のI型への転換をサポートし、骨格筋の強度を低下させる可能性がある。
線維/脂肪形成前駆細胞(FAPs)は筋再生の重要なレギュレーターだが、肥満状況下では骨格筋に慢性炎症、線維化、筋内脂肪蓄積を引き起こす可能性がある。肥満では、主に内臓WATから放出されるアディポカインがFAP脂肪生成を増加させる。
骨髄内脂肪組織(Bone Marrow Adipose Tissue)
現在、MATは骨代謝を調節しているだけでなく、生物全体の代謝に影響を与えている可能性があると考えられている。
正常な生理的条件下では、MATはBATとWATの両方の特徴を兼ね備えた代謝表現型を持つ脂肪細胞で構成されている可能性があり、これは骨髄の脂肪組織が「ベージュ」タイプに似ていることを示唆している。
これらの脂肪細胞のいわゆる「白化」、加齢、肥満、および他の代謝障害に伴うBAT様特徴の喪失は、骨髄環境の有害な変化に関与する。
MATは内分泌機能を有し、leptinの局所的および全身的な分泌に著しく寄与する。
肥満が進行すると、MATから局所的に放出されるレプチンが間葉系幹細胞(MSC)を刺激し、レプチン受容体(LepR)を介して骨形成の抑制と脂肪形成の促進を作用させるようになる。
この結果、レプチン分泌の増強は骨髄内脂肪率を高める正のフィードバックループを作り出す。
骨への脂肪の蓄積は、オステオカルシンやIGF-1のような筋肉に同化作用する因子の放出を阻害する可能性がある。
・サルコペニア予防法としてのエクササイズ
加齢に伴うサルコペニアとSOの予防と進行抑制の第一の方法はエクササイズである。
運動は強力な同化刺激で、筋力、歩行、バランス、および有酸素能力を改善することができる。
レジスタンストレーニングは、サルコペニアに対抗する重要な戦略である。
衛星細胞の活性化と増殖を促進し、筋タンパク質合成を高める一方でそれらの分解を抑制し、結果として筋量と筋力が増加する。
Hippoシグナル経路、特にYAPタンパク質が機械的刺激に対する反応と伝導に関与していることは以前から知られている。
いくつかの研究で、YAPタンパク質活性のトリガー刺激として細胞の形状の変化が指摘されており、特に筋肉の場合レジスタンストレーニングの筋生理学的影響が特に重要かもしれない。
体系的なレジスタンス運動は筋繊維、特に速筋繊維のサイズを増大させる。
骨格筋の肥大能は高齢になると低下するので、患者はできるだけ早くレジスタンス運動を始めることが推奨される(肥大能が低下のは確かだが、年齢問わず筋肥大はするのでご安心を。しかし、きちんとした刺激が必要)。
レジスタンストレーニング以外の種類の運動の有効性については、説得力のある証拠はあまりない。
・サルコペニアにおけるミオカインの役割。筋肉と脂肪組織のクロストーク
定期的な運動が顕著な健康効果をもたらし、慢性疾患の予防や軽減、老化の抑制、延命の役割を果たすことは研究により一貫して示されている。
メカニズムとして、運動中に放出される生物活性物質が挙げられる。
骨格筋は、サイトカインやその他のペプチドを産生・放出し、様々な組織に対してオートクライン、パラクライン、ホルモン作用を及ぼす内分泌器官の役割を担っている。
ミオカイン分泌の障害は、肥満、T2D、サルコペニア、SOなどの加齢関連疾患や代謝性疾患の病因に関与している。
加齢により、apelin, BAIBA, decorin, IGF-1, IL-15, irisin, sesterin, SPARCを含むほとんどのミオカインの分泌が減少しミオスタチンの分泌が増加するが、これらのプロセスは定期的な身体活動によって部分的に逆転することが示されている。
・脳由来神経栄養因子(BDNF)
BDNFは主に脳と骨格筋に存在する神経栄養因子で、学習と記憶に関与する。
神経変性疾患患者では、血漿中のBDNF濃度が低いことが知られる。
低BDNFレベルは、肥満やT2Dの患者にも見られる。
運動はヒトの骨格筋におけるBDNFの発現を増加させ、特にレジスタンストレーニングはBDNFの血漿レベルを増加させる。
BDNFは筋形成と衛星細胞の活性化する。
BDNFは成体骨格筋の衛星細胞に発現し、筋再生プロセスにおいて重要な役割を果たす。
身体活動は若年健常者だけでなく、パーキンソン病患者を含む様々な神経疾患患者における血漿/血清BDNF 値を増加させる。
低BDNF値は血液透析を受けている日本人患者の身体機能の低下、重度のサルコペニアおよびフレイルの有病率と関連している。
他のレビューでは、健康な高齢者と異なる病態を持つ高齢者において運動が末梢BDNF値を増加させることが示された。
BDNFシグナルは、加齢に伴う神経筋機能の調節に不可欠な役割を果たす可能性が示唆されており、これはサルコペニアやSOの病態に影響を与える可能性がある。
肥満と加齢は、世界的な健康コストと認識されている。
どちらの要因も、代謝性疾患を発症するリスクを増大させる。
サルコペニア肥満(SO)は、高齢者の健康に大きな影響を与えます。サルコペニア、特にSOの発症を遅らせ治療するためには、適切な栄養補給に加えてレジスタンストレーニングが唯一の実用的なアプローチである。
身体活動はサルコペニアや加齢に伴う筋機能の低下を完全に抑制することはできないが、サルコペニアの発症・進行を遅延させることは明らか。
このため、高齢になっても、適切な量のレジスタンストレーニングと持久力トレーニングの両方を含む身体トレーニングを実践することが強く推奨される。
50代以降のレジスタンストレーニングと栄養指導、カイロプラクティックによるコンディショニングはぜひ当院にご相談ください。
他とは一味違ったトレーニングをご提供します