加齢と共に老化関連疾患が増加し、中でも骨格筋や免疫系の衰えはそれぞれサルコペニアや免疫老化として現れる。
パンデミック以降、筋力低下による膝関節痛や肩関節痛の発現に危機感を感じ、一念発起してパーソナルトレーニングにお越しになる方が当院でも増加した。
気分次第でトレーニングからカイロのメンテナンスに切り替えられるのも、40代以降の紳士淑女のテンションにはちょうど良いみたいだ。
2018年以降、サルコペニアは筋肉疾患とみなされ、筋力は有害な転帰を予測する上で筋肉量より優れていると考えられている。
サルコペニアの多面的な発症機序として、免疫異常や慢性炎症が議論されている。
免疫系と筋の相互作用はこれまで片側性であると考えられてきたが、近年では骨格筋が免疫学的プロセスや炎症反応を制御していることが明らかにされている。
本日のブログは、老化関連疾患の基礎となるメカニズムを理解し、免疫系機能の強力なレギュレーターとしての骨格筋についての考察をデータを元にまとめていきたい。
リンクのレビューは、筋肉と免疫系の潜在的コミュニケーション経路に関する現在の(まだ断片的ではあるが)知見の概要を記述し、コミュニケーション経路が骨格筋の老化によってどのように影響を受けるか、そして可能な治療戦略について論じている。
Skeletal muscle as potential central link between sarcopenia and immune senescence
・サルコペニアの疾病負担:感染症の危険因子
サルコペニアによる有害事象として、骨折につながる転倒リスク増加、身体障害や機能障害、嚥下障害、QOLの低下、全死亡などが含まれるが、これらに限定されない。
サルコペニアは手術後の感染症リスクの予測因子で、入院から3週間後にサルコペニアと診断された患者は、院内感染のリスクが2倍上昇することが示されている。
また、サルコペニアは高齢者の市中肺炎のリスクと誤嚥性肺炎患者の90日死亡率の両方を予測することができる。
上記の研究は、因果関係を証明するものではないが、筋機能の低下と病原体に対する免疫反応の低下との関連を示唆している。
高齢者におけるサルコペニアの高発生率と感染症リスクの高さを考えると、サルコペニアは高齢者の感染症関連疾患を改善するための治療ターゲットになる。
・免疫機能の中心的制御因子としての骨格筋の可能性
この20年間で骨格筋は純粋な運動単位であるという認識が変化し、免疫調節機能を持つ臓器として認識されつつある。
骨格筋細胞は様々な可溶性因子、細胞表面分子、細胞間相互作用を介したシグナル伝達により、免疫機能を調節する。
筋肉と免疫系の相互作用に関する知見はかなり進んでいるが、加齢による影響はあまり知られていない。
サルコペニアはこの相互作用を著しく阻害し、サルコペニア患者に見られる臨床的転帰を説明する可能性を与えている。
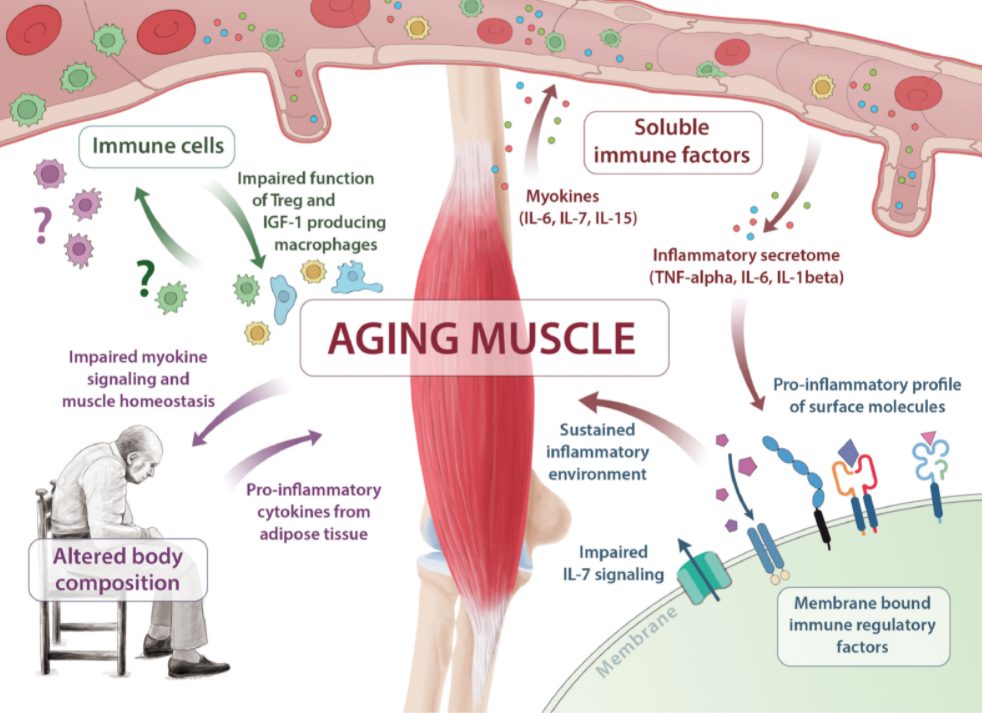
・水溶性因子
筋肉はサイトカインやその他のペプチドを産生・放出する内分泌器官で、多くの組織に対してオートクライン、パラクライン、エンドクライン活性を発揮する。
その結果、これらの可溶性因子は一般にミオカインと呼ばれている。
骨格筋のセクレトームにはプロテオミクスプロファイリングによって300以上のマイオカイン候補が同定されている。
IL-6、IL-7、IL-15、LIFなどのマイオカインは免疫系を調節する。IL-7やIL-15などのミオカインの血清濃度は年齢と逆相関し、骨格筋と加齢による免疫機能低下との関連性が示唆されている。
・IL-15:免疫機能維持のためのレシピ?
IL-15はIL-2と同じサイトカインファミリーに属し、ヤヌスキナーゼ1および3、STAT3およびSTAT5経路を介してダウンストリーム効果を伝達する。
IL-15は筋肉を含む様々な細胞や組織で発現し、IL-15がミオカインであることを示す証拠が増えつつある。
トレッドミルトレーニングを行った肥満ラットでは、筋肉における IL-15mRNA の発現と IL-15 免疫反応性が、座ったままのラットに比べて有意に上昇した。
齧歯類で見られた効果を裏付けるように、激しいレジスタンス運動プロトコルを完了したヒト生検では、24時間の回復後にIL-15mRNAレベルが2倍高くなり、未訓練の男性被験者では運動後にIL-15血漿レベルの増加が観察された。
運動に対するIL-15の放出は脈動的で、長期間にわたって持続することはない。
分子レベルでは、5′-AMP活性化プロテインキナーゼ(AMPK)が骨格筋の細胞内エネルギーレベルのセンサーとして作用している。
AMPKが機能的不活化したトランスジェニックマウスでは、IL-15のmRNAと血漿濃度の両方が減少したことから、AMPKは運動によるIL-15の産生と放出に極めて重要であることがわかった。
AMPKの活性は加齢とともに低下するため、老化した筋肉におけるIL-15シグナルの障害の根底にある分子メカニズムの可能性を示している。
運動誘発性のIL-15レベル調節が持つ意味は深い。
IL-15は免疫機能の維持に重要であると同時に、筋形成を促進して脂肪組織の分布を減少させる。
さらに、IL-15は骨格筋を構成する他の細胞タイプ、例えば線維脂肪前駆細胞(FAP)の増殖を促進する一方で、FAPの脂肪細胞への分化を抑制して筋再生を促進する。
また、IL-15は脂肪組織に対して異化作用を及ぼして脂肪率を効果的に減少させ、体組成を調節する。
サルコペニアの病態に脂肪組織が関与していることを考えると、IL-15のシグナル伝達障害はサルコペニアと肥満の合併に寄与している可能性がある。
さらに、IL-15は免疫細胞の発生と維持に極めて重要な役割を担っている。
NK細胞の増殖、活性化、分布はIL-15によって制御されている。
NK細胞と同様にCD8T 細胞のホメオスタシスを調節する。
NK細胞とCD8T細胞は、ウイルス性病原体の効果的な除去や腫瘍細胞の破壊に必要。
またIL-15は、好中球の移動と貪食を促進することによって自然免疫反応にも関与している。
したがって、IL-15のシグナル伝達は、体組成や免疫機能の維持に不可欠である。
しかし、老化マウスモデルでは、血清中のIL-15と可溶性IL-15Rαの減少が観察され、老化ラットでは筋肉内のIL-15とIL-15Rαの発現が減少していることが判明している。
ヒトにおいても加齢に伴うIL-15血清レベルの低下が報告されている。
・炎症促進作用と異化作用
炎症性セクレトームの一部として、IL-6は好中球、T細胞、B細胞、マクロファージ、内皮細胞などの多くの細胞から感染や組織損傷に応答して分泌される。
IL-6シグナルは、病原体に反応する免疫機能の活性化の他に、加齢に伴う慢性低悪性度炎症の一部としてサルコペニアの発症に関与していると考えられている。
慢性的な低悪性度炎症はIL-6シグナルに長期間曝されることと関連する。
IL-6は、筋アナボリック作用とエネルギー恒常性を鈍らせることによって筋萎縮を促進し、また、筋カタボリック作用を直接的に媒介する可能性があることが示されている。
IL-6を慢性的に過剰発現させたトランスジェニックマウスは、カテプシン活性の上昇と同時に筋肉量の著しい減少が観察されている。
IL-6は単独で筋肉の消耗に作用するのではなく、炎症反応を媒介する他の因子との相乗的相互作用に依存している可能性が高い。
IL-6を介した筋カタボリック作用は、(a)IL-6への慢性的な曝露、(b)TNF-αなどの他の炎症性サイトカインの同時活性に依存していると思われる。
・抗炎症作用と同化作用
IL-6は主要なミオカインとして作用することもできる。
IL-6の血中濃度は運動後に急上昇し、運動後の筋恒常性を回復するために IL-6が骨格筋から放出されることが示唆されている。
実際IL-6シグナルは、衛星細胞の機能を制御し、グルコース代謝を促進することで骨格筋の再生と肥大に極めて重要。
運動は筋小胞体からCa2+を放出させる。
Ca2+に応答して、活性化T細胞核因子(NFAT)の活性化因子であるカルシニューリンが筋細胞におけるIL-6の産生を媒介する。
細胞内Ca2+レベルの上昇はTNF-αの発現を抑制し、その結果運動に応答してIL-6のみが分泌されてTNF-αのレベルはほとんど変化しない。
したがって、運動によって誘発されるIL-6放出は、慢性低悪性度炎症で見られるIL-6曝露とは著しく異なる生物学的プロフィールを示す。
過去の研究では、3時間のサイクリング後に低用量の大腸菌エンドトキシンを注射した被験者にはTNF-α反応が見られなかったが、同量の毒素を注射した安静時対照群ではベースラインレベルと比較して最大で3倍のTNF-α増加が観察されている。
TNF-αはサルコペニアの病因に関与しているだけでなく、T細胞のCD28発現を低下させ、免疫老化の特徴であるCD28陰性T細胞の蓄積をもたらす。
また、特定の状況下ではIL-6は抗炎症作用も持つ可能性もある。
ヒトIL-6は、健康な被験者においてIL-1受容体拮抗薬(IL-1ra)とIL-10の分泌を誘導した。
IL-1raはIL-1、IL-1α、IL-1βによって媒介される炎症作用を阻害し、組換えIL-1raは自己免疫疾患の治療で試験中の成分。
IL-10はTh1炎症反応を制限し、NF-κBシグナルとTNF-αの放出を抑制する。
注目すべきは、IL-10はB細胞の分化にも関与していること。B細胞の分化は免疫老化の一部として老化した人々で損なわれている。
結論としては、IL-6はまさに “諸刃の剣 “で、慢性的に曝露されてTNF-αのような炎症性サイトカインが同時に作用すると、IL-6は炎症性を示し、最終的に筋カタボリックと免疫恒常性の崩壊を引き起こす。
一方で炎症性サイトカインが存在しない場合、運動に反応してIL-6が脈動的に放出されることは、筋形成と炎症反応の調節に極めて重要となる。
サルコペニアでは、加齢に伴い骨格筋の機能が徐々に失われるため、IL-6シグナルが炎症性プロファイルに移行する可能性があることを示唆している。
・IL-7
ヒトにおいて加齢に伴うIL-7血清レベルの低下が報告されている。
IL-7は骨格筋細胞から発現・分泌されることからミオカインに分類されるようになった。
運動によって高齢者で観察されるIL-7レベルの低下が回復することから、骨格筋がIL-7の供給源となる可能性がある。
IL-7受容体ノックアウトマウスは、免疫老化に特徴的な初期リンパ球形成の欠損を示すことから、IL-7シグナルの欠陥は、骨格筋と免疫老化の表現型との関連に関与していることが示唆される。
・膜結合因子と老化に伴う分泌表現型
膜結合因子は、免疫と筋システムのインターフェースの重要な側面を構成し、骨格筋はICAM-1、ICOSL、CD40、B7-H1、NKG2DL、PD-L1など重要な免疫調節分子を発現する。
これらの分子の発現に及ぼす加齢の直接的な影響については、まだ解明されていない。
加齢に伴って蓄積する老化細胞、すなわち内皮細胞や上皮細胞は、IL-1β、IL-6、IL-8、TNF-α、IFN-γなどの過剰発現を伴う老化関連分泌表現型(SASP)を発現している 。
筋損傷により若齢マウスに老化細胞が蓄積すること、老化細胞をマウス骨格筋に移植すると筋線維に老化マーカーが誘導されることから、骨格筋に存在する細胞自体の老化が、老化に伴う分泌表現型を誘導している可能性がある。
組織常在細胞の老化は、SASPを介してパラクライン効果を発揮し、老化した筋肉細胞を調節する可能性があり、骨格筋の老化と免疫老化の間にさらなる関連を与える可能性がある。
・細胞因子:筋肉と免疫細胞の相互作用
骨格筋の再生能力は、骨格筋と免疫細胞との相互作用に依存している。
免疫細胞は傷害に応答して骨格筋に浸潤し、壊死細胞を除去し、衛星細胞の増殖と分化に必要な成長因子を分泌して筋の恒常性を回復させようとする。
免疫細胞の生理的機能は加齢とともに徐々に失われ、骨格筋の再生能力は損なわれていく。
骨格筋に浸潤するT細胞の主要サブセットは、筋に浸潤するCD4+ T細胞の約50%を占めるCD4+ FoxP3+ Tregsで、組織損傷時の筋炎症を制御している。
Tregの機能は、IL-33シグナルに依存している。
骨格筋では、IL-33は主に組織傷害に応答して線維/脂肪形成前駆細胞に似た細胞によって発現される。
高齢動物では、IL-33の発現が低下し、IL-33を分泌する線維/脂肪形成前駆細胞に似た細胞の数が減少するためIL-33シグナルは著しく鈍化している。
IL-33を注射して老齢マウスのTreg機能を回復させると、筋肉の再生が改善することが報告されている。
Tregは組織再生を促進するだけでなく、筋肉の炎症を抑制することができる強力な炎症制御因子。
したがって、Tregの機能異常は老化した筋肉において炎症による異化作用を促進する可能性がある。
Tregは骨格筋の炎症と再生の両方を制御するため、Treg活性の維持は高齢になっても筋肉の健康を維持するために極めて重要。
マクロファージは対応する刺激に基づいて連続した表現型を示し、炎症促進性と抗炎症性の両方の特性を示す。抗炎症性マクロファージが産生するIGF-1は組織再生の主要なドライバーで、組織の炎症を制限する。
全身性のIGF-1は主に肝臓で産生され、血清レベルは加齢とともに低下する。
老齢マウスではマクロファージの極性形成が損なわれていることが報告されており、高齢者における抗炎症性マクロファージの活性低下は、骨格筋の萎縮と炎症反応の両方に寄与していると考えることができる。
結論として、骨格筋はサルコペニアと免疫老化の病態に中心的な役割を担っている可能性がある。
マイオカイン、膜結合因子、細胞間相互作用は骨格筋の加齢によって影響を受ける潜在的なコミュニケーション経路でありその過程は多くの悪影響をもたらす。
・サルコペニアと免疫老化:双方向の関連性
ヒトは加齢に伴い免疫系が大きく変化する。これらの変化を包括して免疫老化という言葉が使われている。
ここまで骨格筋が免疫制御特性を示すこと、慢性的な低悪性度炎症が筋力低下を誘発する可能性があることを概説してきた。
骨格筋が免疫機能の調節因子であるという概念は比較的新しく、筋-免疫系に新たに複雑な層を加えている。
筋肉と免疫系のつながりは、双方向性である可能性がある。
慢性的な低悪性度炎症は、炎症性セクレトームを介した多面的なメカニズムにより筋肉の異化を誘発する。
同時に、骨格筋のホメオスタシスは健康な免疫機能の一端を担っている。
ミオカインシグナルが十分に伝達されず、膜結合因子が炎症性プロファイルに変化し、免疫細胞の再生能力が損なわれると免疫機能に支障が生じる可能性がある。
生物学的老化では、骨格筋がサルコペニアと免疫老化の間の中心的なリンクとして作用することにより、筋-免疫系の恒常性の均衡を乱す可能性があることを提案する。
老化した生体システムでは、運動不足、代謝の変化、慢性的な低悪性度炎症の蓄積により、健康な筋機能が徐々に失われていく。
そして、筋機能の低下は免疫の調節と維持に必要な骨格筋細胞のシグナル伝達を抑制し、免疫と筋システムの機能不全が互いに支え合う悪循環に陥る。
サルコペニア患者は感染症のリスクが高く、免疫機能の低下と臨床的な相関があることが示唆されている。
がんや自己免疫疾患の発症率は加齢とともに増加し、一方、筋肉量は平均して減少している。
このことは示唆的ではあるが、因果関係を推論することはできない。サルコペニアが癌や自己免疫疾患の発生率に及ぼす影響を調査する縦断的研究が必要である。
・展望:筋肉・免疫系治療
人口動態の変化は現代の大きな課題で、高齢化が進むにつれて加齢に伴う病態がより多く見られる。
サルコペニアと免疫老化は骨格筋が本質的に関連しており、実行可能で効果的な治療が求められている。
運動は体力の維持・向上を目的とした身体活動の総称であり、その有効性は既に証明されている。
サルコペニアに関しては、運動は骨格筋の代謝と機能を改善し、最も重要で一貫した治療オプション。
運動が高齢者の免疫機能をサポートし、特にワクチン反応を改善し、慢性炎症を抑制することが示されていることは重要な点である。
運動は加齢による有害な影響から免疫と筋機能を保護する可能性がある。
身体活動レベルが全死因死亡率と逆相関であることから、運動は長寿の主要なドライバーとして浮上している。
カロリー制限の筋機能への影響は、カロリー制限の潜在的な老化防止効果に加えて、循環する炎症性サイトカインレベルの減少に起因する可能性があり、筋肉と免疫系機能の間のさらなる関連性の可能性を示している。