今回のブログは、腸内細菌叢と慢性疾患との相関や、スポーツパフォーマンスにおける腸内細菌叢の存在意義やメカニズムに関するレビューを紹介したい。
いつもはなるべく簡潔にまとめようと努めるところだが、腸内細菌叢の記事を要約するのは難しいことがわかっているので、今回は腰を据えてじっくり(かつ、なるべくさっぱりと)まとめ。
このレビューは腸内細菌叢の組成を調節するための身体活動と栄養介入の組み合わせにも焦点を当てており、エリートアスリートにおける様々な病態の予防・治療やパフォーマンスの向上を最終目的とした腸内細菌叢調節戦略(食事パターン改良、サプリメント摂取、トレーニングプログラム)の開発に利用できる可能性があるため非常に興味深い。
レビューの著者は、腸内細菌叢が健康や疾病の多くの側面において意味を持つことから、宿主の生理学(病理学)において「真のコンダクター」であると表現している。
このような文学的な表現が使われることは珍しいが、なるほど、腸内細菌叢の役割を理解すれば、まさに的を射た表現だと納得できる。
腸内細菌叢-栄養-身体活動トライアドという新しい概念を、治療の最適化や病気の発症及び進行の遅延、スポーツのパフォーマンス向上のために実際に使用するため現在様々な研究が進んでおり、新しい知見が提供する多くの可能性は将来さまざまな道を開くだろう。
The Nutrition-Microbiota-Physical Activity Triad: An Inspiring New Concept for Health and Sports Performance
・腸内細菌叢とは
腸内細菌叢は消化管に生息する様々な微生物のことを指す。
細菌叢は、皮膚、泌尿器系、呼吸器系など様々な部位に存在するが、最も研究されているのは腸内細菌叢。腸内細菌叢は、主に細菌(1013個)から構成されている。
同様に、細菌に感染するウイルス(「ファージ」と呼ばれる)も細菌叢の中で頻繁に検出され、細菌集団の存在量、遺伝子プロファイル、遺伝子発現を変化させることができることからビローム(=ウイルス叢)は、腸内細菌叢の生理・病理学的パズルにおけるもう一つのピースである。
腸内細菌叢は体重70kgの人で最大1.5kgに達することもある。
指紋のように、腸内細菌叢は質・量ともに各個人に固有のもの。
平均的な微生物叢に相当する160種の細菌のうち、すべての人間に存在するのは15~20種程度。
腸内細菌叢の密度は、消化管に沿って変化していく。胃、十二指腸、空腸ではかなり低く、回腸と結腸で増加する。
胃は、乳酸菌、連鎖球菌などの耐酸性微生物と通性嫌気性菌を選択的に宿主とする。
小腸では、細菌叢は通性嫌気性菌(乳酸菌、連鎖球菌、腸内細菌など)と嫌気性菌(ビフィドバクテリア、バクテロイデス、クロストリジア)で構成されている。
大腸では、腸の蠕動運動が遅く嫌気性であることから、最も細菌の多様性(1000種以上)と密度が高い。大腸の細菌数の80-90%は腸内細菌叢の密度は、消化管に沿って変化していく。胃、十二指腸、空腸ではかなり低く、回腸と結腸で増加する。
胃は、乳酸菌、連鎖球菌などの耐酸性微生物と通性嫌気性菌を選択的に宿主とする。
小腸では、細菌叢は通性嫌気性菌(乳酸菌、連鎖球菌、腸内細菌など)と嫌気性菌(ビフィドバクテリア、バクテロイデス、クロストリジア)で構成されている。
大腸では、腸の蠕動運動が遅く嫌気性であることから、最も細菌の多様性(1000種以上)と密度が高い。大腸の細菌数の80-90%はファーミキューテス門とバクテロイデーテス門の2つの細菌門で占められている。
ヒト成人ではバクテロイデス、ユーバクテリウム、ルミノコッカス、クロストリジウム、ビフィドバクテリウムが主要な細菌属で、腸内細菌叢の構成は種によって、また同じGIセグメント内でも粘膜付近の区画と消化管/便の間で異なっている。
腸内細菌叢は基質や難消化性食物残渣を発酵し、ヒトの細胞には存在しない一連の酵素のおかげで栄養同化を促進したり、いくつかのビタミンの合成に参加して消化に直接的な役割を果たしている。
また、消化管全体の機能にも影響を与える。
腸管壁のバリア機能に不可欠な腸管免疫系の働きに関与する。
一方で、腸内細菌は宿主との共進化を通じて局所的な環境制約に適応してきたが、生態系とその機能の複雑さゆえに宿主-細菌叢の相互作用は,多くの病態で破壊されうる脆弱な均衡を示している。
・腸内細菌叢と健康・疾患
腸内細菌叢はの貢献は腸内にとどまらず、代謝、免疫系など多くの機能に関係する。
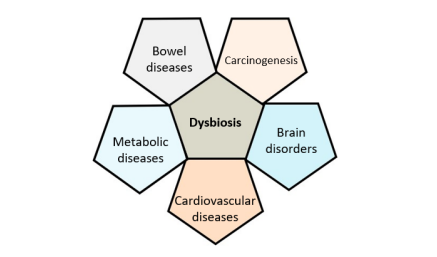
腸内細菌叢の質的・機能的変化であるディスバイオーシスと呼ばれる細菌叢組成の変化は、慢性炎症性腸疾患(IBD)、過敏性腸症候群、大腸がん、代謝性疾患(2型糖尿病、肥満)、うつ、心疾患など様々な病態と慢性化に関与している。
ディスバイオーシスは、特に自己免疫疾患や炎症性疾患が関与する疾患の病因となる可能性があるため、腸内細菌叢の質的・機能的変化を把握することは重要。
まず、腸内細菌叢は消化管で観察される自然な炎症に関与している。
炎症は、免疫と密接に関連する重要な生物学的プロセス。
生理的に低レベルの炎症は免疫活性化に不可欠で、細菌叢を制御することが可能。逆に重篤な炎症反応はグラム陰性菌の表面にあるリポ多糖(LPS)などの炎症性細菌成分の存在など、病原性種の存在によって引き起こされる。
これらの抗原によって局所的な炎症が引き起こされ、腸管壁の透過性が上昇し、LPSは腸壁を通過して血流に入り、他の標的組織で全身性炎症を引き起こす。
・消化器系疾患との明確な関連性
クローン病や潰瘍性大腸炎などの慢性炎症性腸疾患は、腸の免疫系が不適切に活性化された結果とされる。抗生物質治療を受けている患者では症状が改善し、腸壁が糞便と接触しなくなった人では炎症性腸管病変が消失することから、腸内細菌叢が関与している可能性がある。
細菌叢の構成では,ファーミキューテス門に属する細菌が減少し,プロテオバクテリア門に属する細菌が増加する。
ファーミキューテス門に属し、ヒトの腸内細菌叢で優勢な細菌の一つであるフィーカリバクテリウム・ プラウスニッツィイは、IBD患者、特にクローン病患者で特に減少している。
IBD患者は腸内細菌叢の異常により、潜在的に病原性や炎症性の微生物が定着・増殖しやすくなっている可能性がある。
クローン病には、カンジダ・アルビカンス、リステリア・モノサイトゲネス、ヨーネ菌、バクテロイデス・フラジリス、付着性および侵襲性の大腸菌が関与している。
・癌
ディスバイオーシスは、様々なメカニズムで癌の発症や進行を促進する可能性がある。
- 特定の微生物の存在や腸内細菌の異常は、いくつかの腫瘍と関連している。
胃癌のリスクを高める細菌であるピロリ菌や大腸癌リスクを高めるコリバクチン産生大腸菌のように、DNA損傷を引き起こす可能性がある。
細菌叢のアンバランスは、β-カテニンシグナル伝達経路などの発がん経路を異常に刺激することができるいくつかの種(フソバクテリウム)を優遇する。 - いくつかの炎症性または免疫抑制性のシグナル伝達経路が、ディスバイオーシスの存在下で活性化される。さらに、ディスバイオーシスは腸の透過性を高め、腸管内腔から体内への発がん性化合物の拡散を可能にする。
- ディスバイオーシスは、がん細胞の生存に関連する遺伝子を誘発し、腫瘍の進行を促進する可能性がある。
- 最近、腫瘍内の細菌が同定されるようになった。その性質、起源、およびがんの発生・進行への影響を理解することは、新しい治療法を提供する可能性がある。
・代謝性疾患と循環器疾患
心血管系疾患(動脈硬化、高血圧、脳卒中など)や代謝性疾患(糖尿病、肥満)は、遺伝、栄養、環境など多因子から構成され、腸内細菌叢もこれらの発生に関与していることが次第に明らかになってきている。例えば、肥満マウスの糞便細菌叢を無菌マウスに移植すると、無菌マウスは有意かつ急速に体重を増加させる。
腸内のグラム陰性菌は、炎症性リポポリサッカライド(LPS)の局所レベルを増加させる。
LPSは血流に乗って他の臓器・組織(肝臓、脂肪、筋肉など)に到達し、そこで糖尿病や肥満の前提となるインスリン抵抗性の発達を促す低レベルの慢性炎症を発現させる。
さらに、いくつかの細菌代謝物は、2型糖尿病、動脈硬化、動脈性高血圧などの心代謝性疾患の発症に決定的な役割を持つ可能性がある。最も説得力のあるメカニズムは、トリメチルアミンに関するものである。細菌が産生するこの老廃物は、血流に乗り循環する。そして肝臓で酸化され、動脈硬化プラークの形成を促進する物質であるトリメチルアミン-N-オキシドになる。
・脳
腸を調節する神経系(腸管神経系、ENS)には、約2億個の神経細胞がある。
その主な機能は、腸の運動性を確保することである。
腸は中枢神経系(CNS)と密接に、かつ双方向に相互作用している。これはENSが第二の脳と呼ばれる所以である。
ディスバイオーシスによって中枢神経系とENSに伝達される情報が変化し、両器官の機能が変化する可能性がある。
これには複数のメカニズムが関与している可能性がある。一つは細菌叢に由来する化合物(代謝物または構造要素)が腸壁を通過して拡散し、ENSを直接変調させる可能性。これは、腸、迷走神経、そして間接的には脳の働きに影響を与える。これらの化合物は、血流を介して直接中枢神経系に到達することもある。
脳内で、直接、あるいは代謝後にいくつかの脳機能に悪影響を及ぼす可能性がある。
また、細菌はセロトニン経路のように、腸に存在し脳につながる腸内分泌細胞と相互作用することによって、中枢神経系によって制御されている内分泌機能を間接的に調節することができる。
これらの知見は、パーキンソン病やアルツハイマー病などの神経発達障害や神経変性疾患において観察されるディスバイオーシスが、これらの患者に見られる消化器系の障害だけでなく、神経症状にも寄与しているのではないかという仮説を支持するものである。
・個別化治療に向けて
肥満、メタボリックシンドローム、クローン病患者を対象とした試験で、糞便移植はいくつかの生物学的パラメータを改善することが示されたが、その効果は非常に緩やかなものだった。
そのため、各患者の状態や微生物叢の特徴に合わせた個別化された介入方法の開発に焦点を当てた研究が提案されている。例えば、細菌叢は一部の薬剤、特に抗がん剤と相乗効果を発揮する可能性があるため、これらの薬剤と細菌叢の機能を適切に回復させるための介入(プロバイオティクス、糞便移植、代謝産物など)を併用することが考えられる。
疾病とヒト細菌叢に関するメッセージ、課題、将来の方向性
・腸内細菌叢は、宿主の生理(病態)において、まさに「オーケストラの指揮者」である。
・腸内細菌叢の異常は、多くの慢性疾患に関与していることが知られている。
・細菌叢は、いくつかの薬物と相乗効果を発揮し、慢性疾患における薬物の効果を調節する可能性がある。
・将来的には、細菌叢を用いた検査によって個々の患者の薬剤に対する反応性を予測できるかもしれない。
・腸内細菌叢の組成調節因子としての食事と身体活動に関する研究が必要。
・腸内細菌叢の組成に影響を及ぼす食事
現代の西洋食、特に高脂肪食や高糖質食は病原体感受性、肥満、自己炎症性疾患の機序に好都合に細菌叢を持続的に変化させることが示唆されている。
大栄養素(脂肪、タンパク質、炭水化物)の量、種類、バランスは、腸内細菌叢に大きく影響する。
脂肪
高脂肪食(HFD)は低脂肪食と比較して、酪酸を含む短鎖脂肪酸(SCFA)およびビフィズス菌の糞便中濃度を著しく低下させる。
いくつかのヒトの研究では、HFDが総嫌気性細菌叢とバクテロイデスを増加させることが実証されている。
腸内細菌叢の組成には、脂肪の質が重要な役割を果たす。例えば、HFDは主にn-6系多価不飽和脂肪酸(PUFA)で構成されており、しばしば抗炎症作用を有し腸内細菌叢を有益に調節するn-3系PUFAが犠牲になっている。
タンパク質
多くの研究で、タンパク質の摂取が細菌叢の多様性と正の相関があることが実証されている。
ホエイタンパク質と糖化エンドウタンパク質を数日間補給すると、ヒト腸内で常在菌のビフィズス菌と乳酸菌が増加し、病原性のB. fragilisとウェルシュ菌が減少する。
エンドウタンパク質の摂取は腸内のSCFA産生を刺激し、抗炎症作用や粘膜バリアー維持につながる。
一方、短期間(1~4週間)の牛肉摂取は、ヒトの細菌叢プロファイルにほとんど影響を与えない。
推奨量よりも多く、なおかつ糖分や脂肪分の多い食事と摂取した場合、牛肉は腸内細菌叢にマイナスの影響を及ぼす可能性すらある
炭水化物
炭水化物は可消化性、非可消化性の2つのカテゴリーに分類され、可消化性炭水化物にはデンプンおよび糖類(例えば、グルコース、フルクトース、スクロースおよびラクトース)が含まれ、これらは小腸で異なる酵素により分解される。
ヒトは、グルコース、フルクトース、スクロースを大量に摂取しているため、ビフィズス菌の相対的な存在量が増加し、バクテロイデスが減少している。
繊維やレジスタントスターチ(RS)などの難消化性炭水化物は、小腸で酵素分解されない。
現在、4種類のRS(RS1-RS4)が認識されており、細菌組成に異なる影響を与える可能性がある。
食物繊維は微生物が利用できる炭水化物として知られているが、西洋食における含有量は不十分。
微生物が利用できる炭水化物は腸内細菌の主なエネルギー源であるため、その量と種類は腸内細菌叢の構成と機能に影響を与える可能性がある。
プレバイオティクス
近年、多くの研究者がプレバイオティクスとヒトの健康との関係を解明しようとしている。
プレバイオティクスは、腸内細菌叢によって代謝されることがあり、その分解産物は血液中に放出されるSCFAsであるため、消化管だけでなく他の臓器にも影響を与える。
プレバイオティクスには、大豆、イヌリン、未精製の小麦および大麦、生オーツ、およびフルクタン、ポリデキストロース、フラクトオリゴ糖、ガラクトオリゴ糖、キシロオリゴ糖、およびアラビノオリゴ糖などの難消化性オリゴ糖類が含まれる。
フラクトオリゴ糖とガラクトオリゴ糖は、人間の健康に有益な効果をもたらすプレバイオティクス。
プロバイオティクス
プロバイオティクスとは生きた微生物のことで、十分な量を投与することで宿主の健康や腸内環境、免疫系へ利益をもたらすため最も研究されている。
例えば、乳製品やヨーグルトなどの乳酸菌を含む発酵食品は、腸の健康を有益に調整し、IBDを治療または予防する可能性がある。
乳酸菌、ビフィズス菌、サッカロミセス株は長い間安全に、そして効果的に使用されてきた。
Faecalibacterium spp.も、有望なプロバイオティクス。
植物性非栄養素化合物
果物、野菜、穀物、その他の植物に存在する化合物は、主要な慢性疾患のリスク低減に関連している。
これらの植物性化合物には、プレバイオティクスおよびプロバイオティクス、ならびにポリフェノール(最大のグループ)およびその誘導体、カロテノイド、およびチオ硫酸塩などのいくつかの化学化合物が含まれる。
ポリフェノールは、フラボノイド、フェノール酸(例えば、クルクミン)、スチルベノイド(例えば、レスベラトロール)、およびリグナンという4つの主要グループに分類できる。
これらは、酸化ストレスを抑制することで健康を促進する。
赤ワインのポリフェノールを摂取している人は、バクテロイデスの存在量が増加する。
果物、種子、ワイン、茶のポリフェノールを定期的に摂取すると、病原性クロストリジウム種(C. perfringensおよびC. histolyticum)の存在量が減少することが報告されている。
最近のレビューで、ポリフェノール代謝物が腸内細菌叢およびミトコンドリアと相互作用し、肥満、うつ病、炎症およびアレルギーなどの多くの疾患に対して効果的であることが示された。
ビタミン
ビタミンの中には腸内細菌叢によって直接生産されるものや、有益/有害な細菌種の存在を調節する役割を果たすものがある。
ビタミンAはビフィドバクテリウム属、ラクトバチルス属、アッケマンシア属の健康に有益な微生物を調節する。
ビタミンB群の中には腸内常在菌によって生産され、潜在的な病原性微生物の病原性/コロニー形成の増加に寄与するものもある。ビタミンC、D、Eの補給は、ビフィドバクテリウムやラクトバチルスなどの有益な種の濃度を高めることによって細菌叢の組成を変化させる。
・腸内細菌と体力・スポーツパフォーマンスとの関連性の可能性
アスリートの腸内細菌叢は特殊な細菌叢?
アスリートにおける腸内細菌叢の変化は、エネルギー消費量、食事、薬物摂取(特に抗生物質)など、個別の要因に依存的。
この分野の研究は急速に拡大している。
データ分析から、アスリート/運動をしている人の腸内細菌叢は、他の集団とは異なり、高い細菌多様性を示すことがわっている。
2014年の研究では、高BMIアスリートグループと比較して低BMIアスリートでは、バクテロイデス門の存在量が減少し、アッカーマンシア属の存在量は増加していた。
他の研究では、VO2peak値が高い個体では、主要な酪酸産生分類群(クロストリジウム目、Roseburia、ラクノスピラ、エリュシペロトリクス)の存在量が増加した。
2019年の研究では、マラソン後にベイロネラの相対量が増加することや、ランナーの便サンプルから得たVeillonella atypicaの菌株をマウスに移植すると、接種動物のトレッドミルでの消耗走時間が有意に増加することが示された。
2020年、2021年のレビューでは、腸内細菌叢のαおよびβ多様性はスポーツ種目間で差がないと結論付けている。
一方で、高いVO2maxを有するアスリートにおいて、ビフィドバクテリウム・アニマリス、ラクトバチルスアシドフィルス、プレボテラインターメディア及びフィーカリバクテリウム・ プラウスニッツィイの存在度が高く、高いVO2maxと静的要素の両方を有するアスリートにおいてBacteroides caccaeの存在度がより高いことを報告したデータもある。
長時間にわたる過度の運動が腸機能に有害な影響を与える可能性を示すデータもある。
激しい運動や長時間の運動は腸管透過性を高め、大腸からの細菌の移動、細菌LPSの血流への漏出、および全身性炎症の活性化が促進される。
GI症状(腹痛、吐き気、下痢)は、激しい運動後のアスリートの70%が報告しており、その頻度は、レクリエーション運動をしている人よりもエリートアスリートで高い。
・腸内細菌は身体活動調節に敏感:運動不足モデルからの教訓
座位が多い参加者や、特定の条件(加齢に関連した病理、GI疾患、肥満や変形性関節症などの代謝性または炎症性疾患)を有する集団におけるトレーニングを用いた介入研究は、運動が腸内細菌叢に有益な効果をもたらすことを示している。
ヒトを対象とした研究は多くないが、運動またはトレーニングプログラム開始後の特定の細菌群の変化に関する縦断的研究のレビューにおいて、BMIが運動に対するヒトの細菌叢の反応における決定要因であることがわかっている。
他の研究では、6週間の有酸素運動後に、放線菌、バクテロイデテス、ファーミキューテス、プロテオバクテリアおよびVerrucomicrobiaの増量変化が、BMI25kg/m2を超える一見健康な人の糞便微生物叢で観察された。
逆に、痩せた被験者の腸内細菌叢は、フィーカリバクテリウム・ プラウスニッツィイ属およびラクノスピラ属の存在量が増加しており、バクテロイデスを減少させることによって有酸素運動に反応していると報告された。
研究は増えつつあるが、異なるトレーニング様式がヒトの腸内細菌叢に及ぼす影響については、まだ調査中である。
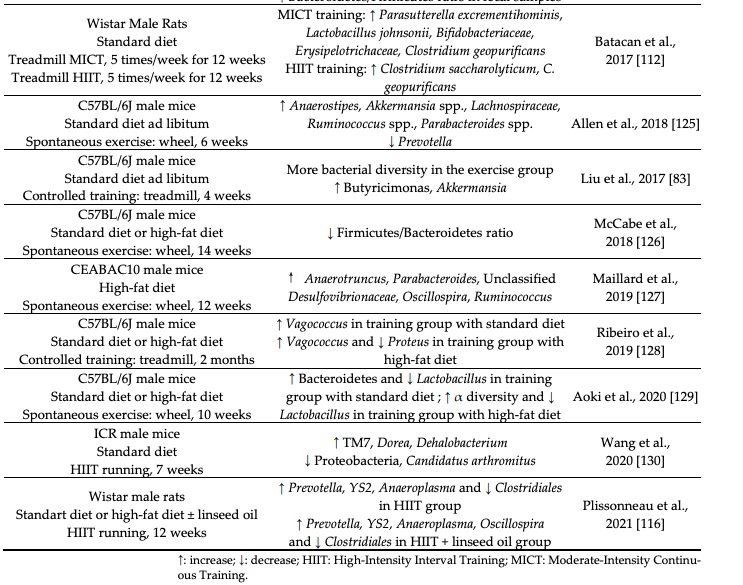
微小重力研究データは、宇宙飛行が宇宙飛行士の消化管の細菌叢組成に影響を与えることから、腸内細菌が急激な活動低下に対して敏感であることを示唆している。
また、骨格筋で代謝されるSCFAであるプロピオン酸は、低活動期間後に採取した便サンプルで有意に減少していた。
データの数は限られているものの、ラクノスピラ科が活動低下に対して特に敏感であり、活動低下-腸内細菌叢軸において重要な役割を果たすかもしれないことを示唆している。
腸-筋肉-脂肪組織軸バクテリアを含まない(無菌状態)、あるいはディスバイオーシスモデルを用いた研究では、腸内マイクロバイオータと脂肪組織と骨格筋という運動能力にとって重要な二つの組織の間に「クロストーク」が存在することが明らかになった。
最も重要な発見は、無菌マウス(腸内細菌叢を持たない)に肥満マウスの微生物叢を移植した後、移植を受けたマウスは食事に何の変化もないにもかかわらず、脂肪表現型を発現すること。
肥満の人は痩せた人に比べてディスバイオーシスが特徴的である。
肥満マウスの腸内細菌叢(その組成は高カロリー食の影響を受ける)は痩せ型マウスの細菌叢よりも多くのカロリーを抽出する。さらに、肥満による腸内細菌の異常は、空腹時誘導脂肪因子(FIAF)の発現を低下させ、リポタンパク質リパーゼ(LPL)の活性を上昇させ、輸送を促進する。
そして、末梢組織の脂肪酸の貯蔵につながる。
肥満のある人の細菌メタゲノム配列決定により、細菌の遺伝子数が減少し、その結果、健常者と比較してα多様性とβ多様性が減少していることが明らかになっている。
腸内細菌叢が代謝器官である骨格筋に与える影響について、本格的に調査されたのは比較的最近。
経口プロバイオティクス補給(Lactobacillus reuteri100-23e および Lactobacillus gasseri 311476e)は、前脛骨筋および腓腹筋におけるE3リガーゼ(タンパク質のユビキチン化とプロテアソームによる分解を担う)、ならびにアトロジン-1、MuRF1およびカテプシン-L(萎縮マーカー)の発現を減少させ、去勢マウスにおいて筋萎縮を妨げた。
また、タンパク質1A/1B-軽鎖3(LC3)のダウンレギュレーションを介して、筋肉の分解に関与するリソソームのオートファジーを減少させた。
腸内細菌叢が重症/慢性病態における筋肉量の維持に不可欠な役割を果たす可能性が示唆された。
筋肉量調節への影響の他に、腸内細菌叢と骨格筋の機能的関連性を評価した研究もある。
ブタからアキセン系マウスへの菌叢移植が筋肉の表現型に与える影響についての研究では、レシピエントのマウスはドナーの表現型を模倣する傾向があった。筋肉の脂肪生成は有意に増加した。
さらに、マウスの筋肉の構造と機能はドナーの筋肉の表現型に近かった:筋線維の断面積がわずかに減少し、遅筋線維型への移行が見られた。
他の研究では、腸内細菌叢の枯渇(抗生物質治療により誘発)が、グルコースホメオスタシス機能障害に関連する収縮性筋持久力に影響を与えることが示された。
これらの有害な効果は、天然の微生物叢の再供給によって正常化された。
腸内細菌は、炎症および酸化還元経路の制御、バイオアベイラビリティおよび代謝産物由来細菌生産の制御、同化および異化プロセスとの相互作用、さらにミトコンドリア生合成、酸化還元および免疫系の制御など、多数の様々な機能を通じて骨格筋と運動およびトレーニングへの適応に不可欠であることが現在明らかになっている。
まとめ
・n-3 PUFAや難消化性炭水化物を含む主な食事大栄養素の量、種類、バランスは、腸内細菌叢に大きな影響を与える。
・多くの食事性化合物が腸内細菌叢の組成を修正する。
プレバイオティクスとプロバイオティクスの摂取は、各患者の特徴に合わせる必要がある。
・スポーツ選手の腸内細菌叢多様性は、スポーツ種目間の差異を検出するために、より低い分類レベルで説明されなければならない。
・腸内細菌は、座りがちな行動(低重力など)に敏感であるが、データは非常に少なく、この問題は徹底的に調査される必要がある。
健康な座位保持者や障害者集団において、腸内細菌叢の組成を最適化するために異なるトレーニング方法を用いたいくつかの介入研究が興味深い結果を示している。
・基礎的なメカニズムに関する研究では、臓器間のクロストーク(すなわち、腸-筋肉-脂肪組織軸)が強調されている。
・食事と細菌叢の調節、健康およびアスリートパフォーマンス
現在、多くの研究がスポーツパフォーマンスを向上させるための特定の食事(ケトジェニックダイエット、高炭水化物ダイエット、高タンパク質ダイエット、グルテンフリーダイエットなど)をテストしている。
例えば、超低炭水化物ケトジェニック食(VLCKD)は、スポーツ中に脂肪の酸化を促進するために使用される。しかし、アスリートの腸内細菌叢に及ぼす潜在的な影響に関するデータはまだない。
また、高炭水化物食は持久系競技の3~4日前にアスリートが摂取することが多く、総エネルギー摂取量の70%以上を占めるが、腸内細菌叢の調節因子としての可能性は研究されていない。
・プロバイオティクス、アスリートパフォーマンス
持久系アスリートには、吐き気、嘔吐、腹部狭心症、下痢などの消化器系疾患が非常に多くみられる。
アスリートにおける免疫低下は、過度のトレーニング負荷の後にも報告されており、心理的ストレス、睡眠障害などと関連しており、これらはすべて呼吸器感染症のリスクを高める。
近年、プロバイオティクスの利用が拡大しており、主に消化器症状や呼吸器感染症を減衰させる目的でスポーツの現場でも利用されている。
多菌種のプロバイオティクスサプリや、発酵食品として長期間摂取した方が良い結果(消化器症状や呼吸器感染症の軽減)が得られるようだ。
プロバイオティクスの有効性は、以下の要因によって説明される。
バリア機能の向上、免疫細胞の活性化(炎症促進/抗炎症経路や免疫グロブリン産生)、SCFA産生促進、腸内環境の悪化 pH、および粘液の産生。
現在、いくつかのデータがプロバイオティクスはスポーツパフォーマンスにプラスの効果をもたらす可能性を示している(2019年国際スポーツ栄養学会のレビュー)。
例えば、低用量(3×1010CFU)及び高用量(9×1010CFU)のLactobacillus plantarum TWK10の6週間の補給が、用量依存的に85%VO2maxの運動中の疲労困憊までの時間を延長し、運動中および回復中の血清乳酸値を減少させたとする研究がある。
栄養、マイクロバイオータ、身体活動の三位一体。
・動物実験では、腸内細菌叢組成に対する身体活動および栄養調節の追加的かつ相乗的な効果が示唆されているが、ヒトでの研究において確認する必要がある。
・高炭水化物食と超低ケトジェニック食がアスリートのマイクロバイオータに及ぼす影響については、これまで調査した研究はない。
・多菌種プロバイオティクスを小袋や発酵食品の形で長期間摂取することは、アスリートに有益な効果を示す
・生物学的食事とトレーニングの組み合わせがもたらす多くの可能性について、その臨床的価値および/または人間工学的価値を明らかにするための調査が必要。
・三位一体による介入は、患者やアスリートのマイクロバイオームプロファイルを考慮したものでなければ効率的でない。
まとめと展望
MMHP(Million Microbiome of Humans)プロジェクトは、100万サンプルを解析し、世界最大のヒトマイクロバイオータデータベースを構築し、マイクロバイオームの可能性を最大限に追求する。
今回のレビューで示したように、腸は栄養や身体活動などの外的要因に応じて細菌群集を適応させることができるため、腸内細菌叢の組成を調節する介入研究を開始することが一つの大きなマイルストーンになる。
科学界と医学界は、栄養-腸内細菌叢-身体活動の三位一体を、それぞれの患者やアスリートに最適化する最良の方法を見つけなければならない。課題は、革新的で独創的、かつ有望な微生物叢に基づく戦略を開発し、身体活動プログラムと組み合わせて、スポーツパフォーマンスと医療を最適化すること。