今日はみんな大好き、筋肉のお話。
腸内細菌叢に興味がある方には面白い記事だと思う。
筋アナボリック効果を日々追求している人や、何らかの疾病で筋機能を取り戻したい方にも参考になるだろう。
長くなると思うが、可能な限りシンプルにまとめてみたい。
高齢者の筋肉量の減少(サルコペニア)やがん悪液質などの様々な疾病、また、スポーツ選手における筋肥大要求など、多様な集団において特異的かつ新たな筋のアナボリック作用の最適化戦略の開発に現在関心が集まっている。
最適化戦略における構成要素の一つに腸内細菌叢がある。
腸内細菌叢の変化は、肥満、糖尿病、心血管疾患の発症と相関する。これらの病態はすべてインスリン抵抗性と低レベルの炎症に関連している。
加えて、筋カタボリック作用は炎症やインスリン抵抗性と密接に関連していることが明らかになっている
腸内細菌叢の組成の変化、生理的状態の均衡、筋肉のカタボリック状態に相関が見られることから、細菌叢が直接的または間接的に筋肉量に影響を与える可能性が示唆されている。
近年、「腸-筋肉軸」仮説が、特にサルコペニア高齢者において提唱されている。
その中で、腸内細菌叢は骨格筋の同化刺激の感度調節に関与している可能性が指摘されている。
最近の研究が、筋肉量と筋肉機能をターゲットにしたプロバイオティクスを含む栄養戦略を開発する理由である。
リンクのレビューは、
1)腸内細菌叢と筋肉の関連性を説明するために実証または仮説されている相互作用と基礎的メカニズムに関する最近のデータを報告すること。
2)異化または同化状態にある集団において、筋肉量減少を抑制または筋肉量増加を促進するために過去に開発されたプロバイオティクス戦略に焦点を当てること。
を目的としたもの。
現在、腸内細菌叢が肥満やインスリン抵抗性などの代謝異常の発生や悪化に関与することが知られているように、腸内細菌叢の組成と多様性が骨格筋の代謝と機能性の決定要因になり、部分的に骨格筋の量と機能を調節に関与していることが示唆されている。
骨格筋は生理的に腸から遠く離れているが、腸から発生するシグナル(微生物代謝物、腸管ペプチド、リポ多糖、インターロイキン)が腸内細菌叢の活動と骨格筋間のリンクを構成し、全身/組織炎症の調節およびインスリン感受性を介して筋機能を調節する。
げっ歯類において、サルコペニアや悪液質を抑制し、健康増進に役立つプロバイオティクスは、主に乳酸菌とビフィズス菌である。
ヒトでも同じ細菌がテストされているが、研究の少なさ、集団の多様性など様々な制約から筋肉量と機能を最適化できる特定の菌株を明らかにすることはできない。
個別化された栄養を設計するために、より明確な集団に関するさらなる研究が必要。
いずれプレバイオティクスに関連した細菌(新しい微生物、細菌の生態系、または特定の腸の生態系に定着しやすい混合物)や筋アナボリック作用を刺激する他のサプリメントなど、筋機能を最適化できる戦略の組み合わせがあらゆる年齢層の個人または患者における筋機能を維持する最善の方法となり得るだろう。
Gut microbes and muscle function: can probiotics make our muscles stronger?
・微生物叢組成の変化と筋肉量および機能の変化:微生物叢、腸、筋肉の関係
*サルコペニア
サルコペニアはフレイル症候群の主要危険因子として認識されており、フレイル症候群がもたらす多くの影響(例:転倒、入院、依存のリスク)により公衆衛生上の大きな問題となっている。
近年、いくつかのグループがサルコペニア、フレイル、高齢者集団における微生物叢組成を研究しており、腸内細菌叢組成は加齢とともに変化し、個人差が大きく、細菌叢の多様性が減少することが十分に立証されている。
虚弱スコア(Groningen Frailty IndicatorまたはRockwood Clinical Frailty Scaleで決定)が高い人は、虚弱スコアが低い人と比較して、乳酸菌、バクテロイデス/プレボテラ、フィーカリバクテリウム・ プラウスニッツィイの相対存在度が著しく減少し、腸内細菌が増加することが示されている。
フィーカリバクテリウム・ プラウスニッツィイが産生する代謝物(酪酸など)には抗炎症作用があり、腸内環境の良好さを示す指標として認識されている。
さらにサルコペニアは、短鎖脂肪酸(SCFA-酢酸、プロピオン酸、酪酸など、難消化性食品の発酵から得られる)産生菌(例、ローズブリア、ユーバクテリウム)が減少することが明らかになっている。
動物実験におけるアクセンティックマウスや抗生物質投与マウスは、従来のマウスと比較して筋肉量と筋力が低下している。
ヒト高齢者では、細菌叢の組成を変化させる交絡因子(投薬、食欲低下、栄養状態、関連する慢性疾患など)のために、微生物叢の因果関係を明らかにするのは困難だが、腸内細菌叢が高齢者における筋量低下や機能の発現に役割を果たす可能性を示唆する証拠が増えている。
*栄養不足
栄養欠乏(必要量に対する食事性栄養素の摂取不足)とその微生物叢への影響が、年齢的に極端な2つの集団、すなわち子供と高齢者において調査されている。
先進国では、高齢者集団における加齢性食欲不振(老年期の食欲および/または食物摂取量の減少)は、加齢に伴う筋肉量の減少を悪化させることを促進させる。
ある研究では、高フレイル老人ホーム入居者(65歳以上)と栄養失調患者のマイクロバイオームには類似性があることが示されている。
2つの集団は共に、炎症性関節疾患と関連する種であるRuminococcus gnavusの増加と、酪酸産生菌(Roseburia intestinalis)の減少を示した。
また、栄養失調リスクのある人や栄養失調の人の特殊性は、重篤な感染症を引き起こす可能性のある特定の日和見病原体の著しい増加。
同じ国の同じ年齢の健康な子供と比較して、重度の栄養失調の子供では微生物叢がプロテオバクテリア門(エンテロバクターまたはカンピロバクターとヘリコバクター科)に富んでいることが分かっている。
このようなコロニー形成は、小腸の形態変化(表面積の減少、透過性の増加、上皮細胞のアポトーシス)につながる腸の炎症の発症につながり、最終的に腸の吸収不良を引き起こす可能性がある。
過去の研究から、Ruminococcus gnavusとClostridium symbiosisはタンパク質合成を促進することによって、栄養欠乏状況における体重増加と成長における重要な決定因子となり得ることが明らかにされた。
*カヘキシア
悪液質患者では急激な筋肉量の減少と腸内細菌叢組成の変化が起こり、全身倦怠感、体重、骨格筋、脂肪量の減少、食事量の減少が観察され、癌と強く関連している。
がん悪液質では細菌叢の変化が観察され、全身性炎症または腸管バリア機能障害が悪液質発症における微生物叢との因果関係を示唆している。
がん患者(大腸がん、乳がん、肺がん)では、ビフィドバクテリウム属、ラクトバシラス属、フィーカリバクテリウム属が減少し、エンテロバクター属やエンテロコッカス属が増加している。
同様の大腸菌パターンは、慢性腎臓病、心臓病、肝臓病を有する他の非がん性悪液質患者でも認められる。
*身体活動
運動不足が健康状態の悪化や腸内細菌叢のアンバランスと相関している可能性があるが、運動不足の状況下で細菌叢が健康増進に果たす因果関係についてまだ十分に検討されていない。
特にヒトにおいて、腸内細菌叢の組成および/または機能に対する運動の効果を調べた研究はほとんどない 。
運動と栄養がコントロールされているげっ歯類の研究では、定期的な身体活動は腸/糞便微生物叢における細菌の多様性と関連することが明らかになっている。
ファーミキューテス/バクテロイデテス比の減少が観察され、カタボリックな状況下で変化した微生物が運動群やアスリート集団では逆に変化することが分かっている。
また、運動の性質や強度によって細菌叢の構成が異なる場合がある。
げっ歯類に自発的にアクセスホイール運動をさせても細菌の多様性に強い変化は見られなかったが、強制運動(トレッドミル)群ではフリー活動動物や座ったままの対照群と比較して、有害な炎症性細菌の割合が増加することが示されている。
大腸炎モデルマウスにおける研究では、強制的なトレッドミル運動は炎症を悪化させて死亡率を高めるが、自発的なホイールトレーニングは保護的であることが実証されている。
食事面では、運動している人は食物繊維の摂取量が多いなど、より「健康的」な食生活をしている傾向がある。これは、フィーカリバクテリウム・ プラウスニッツィイ、ローズブリア・ホミニス(酪酸産生菌)、アッカーマンシア・ムシニフィラ(酢酸およびプロピオン酸産生菌)など、免疫および代謝の健常性に関連する細菌が運動によってより豊富になる理由となる。
さらに、運動は他の酪酸産生菌、すなわち乳酸産生菌の多さと関連し、乳酸は腸内の酪酸産生菌によって酪酸に変換される。
現在、筋肉量および機能と微生物叢の因果関係を評価するため、運動したマウスから他のマウスへの糞便微生物移植(FMT)を研究が行われている。
腸内細菌叢の形成には運動よりも食事の方が強力な関係があるとしても、運動動物(普通食または高脂肪食を与えた)からのFMTは、高脂肪食を与えた座位の動物と比較して脂肪量と炎症(肝臓でのTNF-αとIL-1の発現)の減少、耐糖能の上昇、血清低密度リポ蛋白(LDL)の減少につながることが明らかになった。
また、大腸炎を起こした無菌マウスに6週間、ランニングホイールを自由に使用できるマウスのFMTを行うと、同じマウスに座ったままのマウスの微生物叢を移植した場合と比較して、微生物叢の多様性が高く、大腸炎を抑制し、体格を改善した。
・細菌叢-筋肉軸を説明する可能性のある筋機能メカニズム
現在、多くのレビューでマイクロバイオータが様々な生理的/病理的状態において健康状態(代謝調節(エネルギー消費、脂肪生成/分解、インスリン分泌など)、食欲調節、認知機能)をどのように調節するかがまとめられている。
それらの機能のうち、筋肉に関するもの(炎症、エネルギー/栄養素代謝、インスリン抵抗性、酸化ストレス)は一部である。
以下の段では、筋肉量と機能性に関与する微生物叢に関連する主要な調節機構であるインスリン感受性と炎症に焦点を当て、両機構が酸化ストレスの存在や筋肉レベルの栄養素代謝の変化と密接に関連していることを説明している。
*インスリン感受性-短鎖脂肪酸の役割
腸内の細菌叢によって産生され、細菌叢、腸、筋肉のインスリン感受性との関連を構成しうる数多くの代謝産物の中で(短鎖脂肪酸)SCFAは最も広く研究されている。
SCFA産生菌は、サルコペニアやカシェキシアの人と対照的に、運動によって増加することが繰り返し示されている。
SCFAは、グルコース/脂質のホメオスタシス、炎症の調節、腸と他の組織との連結に関与する。
SCFAの補給は、無菌および抗生物質で処理したげっ歯類で減少していた筋肉量および/または筋力を回復/改善させたとする研究もある。
酢酸の補給(食事または皮下注射)は、ラットの骨格筋におけるグルコースの取り込みとグリコーゲン量を促進し、ウサギでは脂肪酸の取り込みと酸化の増加を通じて、脂質の筋肉内蓄積を減少させることが示されている。
同様に、マウスに酪酸を経口投与すると骨格筋のミトコンドリア機能および生合成、ならびにタイプI(酸化)線維の数が増加し、酸化ストレスおよび筋肉量の減少を防ぐ。
その他にSCFAが筋肉に及ぼす間接的影響として、血流量の増加やエピジェネティックなメカニズムを介した抗炎症作用が挙げられる。
*炎症
細菌叢が変化することで腸の抗炎症反応と炎症反応のバランスが崩れ、高齢者では慢性的な全身性低悪性度炎症につながる可能性がある。
その原因の1つは加齢に伴う免疫システムの調節機能低下(免疫老化)で、病原性細菌による腸内コロニー形成に対抗する能力の低下や、循環内毒素レベル(例えばLPS)の上昇によるもの。
LPSは炎症性経路であるNF-κBの細胞内シグナル伝達カスケードを誘発。NF-κB経路は悪液質、激しい運動トレーニング、サルコペニアでも活性化する。
NF-κBは、筋タンパク質の分解に関与し、炎症を促進し、筋線維の再生を阻害することで筋萎縮に関与する。
同様に、高脂肪食による肥満や糖尿病も炎症マーカーレベルの上昇と関連しており、骨格筋のアナボリック作用に悪影響を及ぼす。
運動は炎症状態にプラスにもマイナスにも作用するが、定期的な運動は座りがちな人や肥満の人に抗炎症作用をもたらすことを示唆する証拠が増えている。
しかし、アスリートのように激しい運動の場合は骨格筋の急性炎症性反応を引き起こす可能性がある。
急性炎症の動物モデルでは、筋タンパク質分解の刺激、タンパク質合成の減少、細胞のアポトーシス誘導や衛星幹細胞の分化阻害が観察される。
類似のメカニズムは、低レベル炎症であっても起こる可能性がある。
診断や誘発された腸の炎症なしに、ラットの全身性炎症のマーカーが上昇している成体または炎症のない老齢動物ラットにおいて、通常刺激される食後の筋タンパク質合成が阻害されていることが判明したが、
それらのラットにイブプロフェンを投与すると鈍化したタンパク質合成が回復したことから、食事による同化刺激に対してタンパク質合成が反応しない原因は、炎症の状態にあることが示唆された。
・プロバイオティクスはカタボリックおよびアナボリック状態において、どのように筋肉量と機能を調節するのか?
細菌叢の活性と多様性が、様々な生理的/病理的状況における筋肉量と機能の決定因子となり得ることを先に述べた。
腸内細菌叢を標的とした戦略は、筋肉量の減少と機能(サルコペニアと悪液質)に対する戦い、あるいは筋パフォーマンスの最適化(スポーツ選手、サルコペニア、病理後の回復)の作用機構として考えることができるだろう。
プロバイオティクスはインスリン抵抗性を抑制し、様々な組織の代謝経路を調節して炎症と酸化ストレスを抑制する能力が繰り返し実証されているため、既存の戦略を補完することができる。
例えば、2種類のプロバイオティクス(ラクチカゼイバチルス カゼイLC122またはビフィドバクテリウム・ロングム BL986)を10ヶ月齢(つまり大人、高齢ではない)のマウスで12週間にわたってテストした結果、対照群と比較して骨格筋量と握力が増加した。
この2つの細菌種は異なる細胞経路に作用するようで、ラクトバチルス・カゼイは抗酸化能を示し(筋肉と腸でSODとGPx活性が上昇)、一方、ビフィドバクテリウム・ロングムは抗炎症性を示した(筋肉と結腸におけるTNF-α、IL-6、IL-1βレベルの低下)。
・異化状態におけるプロバイオティクス
げっ歯類の筋肉異化状態
*癌
乳酸菌が、癌によって悪液質を誘発したげっ歯類を用いた2つの実験で検証されている。
最初の実験では、リモシラクトバチルス・ロイテリおよびラクトバチルス・ガセリ311476を2週間(飲料水中、108CFU/日)投与した白血病マウスを使用。
2番目の実験は、腸ポリポーシスを呈するマウスに、L. reuteri ATCC-PTA-6475を3ヶ月間、前の研究よりも低い用量(105CFU)で毎日補充。
どちらの実験でも、プロバイオティクスが骨格筋質量減少を抑制することが示された。
さらにタンパク質分解の抑制が観察された。
また、腺癌を呈し、ロイコノストック・メセンテロイデスCJ LM119およびLactiplantibacillus plantarum subsp. plantarum CJ LP133を含む凍結乾燥キムチを補給したマウス群の筋肉では、癌の非補給動物群に対してMuRF1( 筋萎縮時に発現量が昂進)およびAtrogin-1(筋タンパク質分解)の発現が減少していた。
これらの実験すべてにおいて、癌の移植に関連する炎症はプロバイオティクスを補給することによってダウンレギュレートされた。
他の研究では、プロバイオティクスは大腸がんを持つマウスの同化作用(タンパク質合成)を刺激し、AKTおよびmTORリン酸化へのプラスの影響とAMPKリン酸化の減少も観察された。
これらのデータは、いくつかの細菌(主に乳酸菌)がプレバイオティクスと関連するかどうかにかかわらず、タンパク質分解の減少につながるがん誘発性炎症の抑制とタンパク質合成の潜在的な刺激の両方を通じて、骨格筋の同化作用を維持できることを確認するものであった。
*加齢
いくつかの研究でマウスに様々な期間(数週間から生涯まで)のプロバイオティクス補給の影響について調査している。
26週齢のSAMP8マウス(老化を加速させるモデル)にラクチカゼイバチルス カゼイPS23を12週間補給したところ除脂肪体重が増加し、筋力(握力)が16週齢のSAMP8マウスと同レベルに回復した。
これは、筋肉における酸素消費率およびミトコンドリア生合成の改善と関連していた。
並行して、酸化ストレスのマーカーが低下し、筋の抗酸化酵素SODとGPxの発現がSAMP8動物で対照群に対して増加した。
炎症状態も、血漿と筋肉の両方で炎症性/抗炎症性バランスの減少(IL-10レベルと発現の増加、炎症性サイトカインの減少)により改善された。
他の研究では、d-ガラクトースによる早老化モデルであるSprague-Dawleyラットにおいて、Limosilactobacillus fermentum DR9、ラクトバチルス・パラカセイOFS 0291、ラクトバチルス・ヘルベティカスOFS 1515)で12週間処理すると、未処理のラットに比べてトレッドミル疲労テスト後の運動能力が増加することが判明した。
各プロバイオティクスを補充した高齢ネズミの筋力と身体的持久力は、d-ガラクトース処理をしていない若いネズミと比較的同程度に増加。
これは、老化マーカーの減少、筋肉と骨における同化因子の増加および炎症状態の改善によって説明された。
興味深いことに、試験したすべての菌株は、酸化状態、AMPKa2、筋原性因子(例:Myf5/MyoD)といった同じ筋経路を標的としていなかった。同化状況において、プロバイオティクス菌株の効果が異なるシグナル伝達経路や代謝経路、組織を標的にしている可能性があることを示唆している。
・ヒトにおける筋の異化状態
がん患者や高齢者の筋肉量と機能に対するプロバイオティクスの影響を調査した研究は、存在しないに等しいが、現在プロバイオティクスは、高齢者とがん患者の両方において筋量と機能を維持するための非常に有望な新しい手段として検討され始めている。
*癌
癌患者において最も使用されているプロバイオティクス戦略は、乳酸菌属(ラクタセイバシラス・ラムノサスCG)。
プロバイオティクスが腸の健康に与える影響として最も知られているのは、下痢の発生を抑制し、抗がん剤治療やがん自体(例えば大腸がん)によって損なわれた腸の健康や細菌叢組成を改善すること。
大腸がんにおいて、プロバイオティクスは病原性細菌のコロニー形成を制限し、腸管バリア機能を改善し、炎症と酸化ストレスを軽減することが示されている(ヒトの場合)。
*加齢
高齢者にプロバイオティクスを投与する研究の大半は消化器系の健康と免疫調節を対象としており、主にビフィズス菌と乳酸菌の属または異なる菌株の混合を対象としている。
全体として、高齢者集団におけるプロバイオティクスの補充は、いくつかのケースでは、病原体の減少を伴う腸内細菌叢の有益な変化をもたらしたが、宿主の健康状態には比較的小さな影響しか及ぼさなかった。
いくつかの研究では、自然免疫の増加に対するわずかなプラス効果を報告している。
免疫状態と細菌叢組成のわずかな改善が観察されたことは、炎症の軽減を介した筋肉への有益な効果の可能性と一致する。
虚弱高齢者にプロバイオティクス(フラクトオリゴ糖とイヌリン)を補給(腸内細菌叢も対象)した他の研究では、13週間の毎日の補給で疲労状態と握力の有意な改善、および虚弱指数の有意な減少がみられた。
・アスリートにおけるプロバイオティクス
*げっ歯類モデル
若いアスリートの代謝的/生理学的反応を模倣できるモデルにおいて、プロバイオティクスが筋機能と身体能力を最適化できるか判断することを目的とした研究がいくつか行われている。
使用されるプロバイオティクスは、乳酸菌とビフィズス菌。
すべての研究において、筋機能および/または身体的パフォーマンスが改善された。
ラクトバチルス・プランタルムTWK10を6週間補給すると、筋量(腓腹筋)が増加し、前肢の握力と水泳持久力が対照マウスと比較して向上した。
Ligilactobacillus salivarius subsp. salicinius SA-03 および ビフィドバクテリウム・ストレイン (B. longum OLP-01) の3-4週間投与も、訓練介入なしに若年マウスの筋肉量と水泳持久力を向上させた。
最後に、加熱殺菌したビフィドバクテリウム・ブレーべ B-3を4週間補給すると、マウスの筋量と握力が向上し、握力増強効果は2週間の投与で既に現れていた。
運動後のVO2max、筋酸化能、グリコーゲン量の増加が観察されたことから、プロバイオティクスを補給した動物におけるインスリン感受性の上昇が、パフォーマンスの向上を説明できると推測される。
*ヒト
既存の戦略に加え、プロバイオティクスを補給することで、アスリートや兵士の筋肉量と機能を向上させることが多く記録されている。
当初は、アスリート集団の感染症や消化器系の問題を管理または予防するためのプロバイオティクス利用に焦点を当てた研究が行われていたが、最近ではプロバイオティクスの補給の目的は、身体能力の向上に移ってきている。
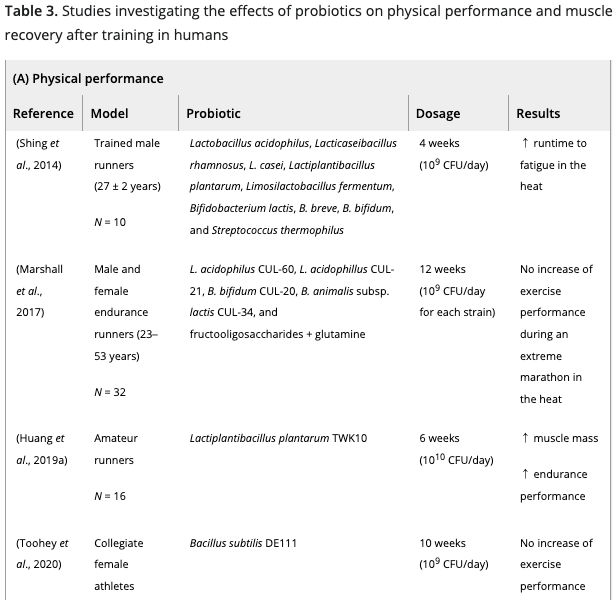
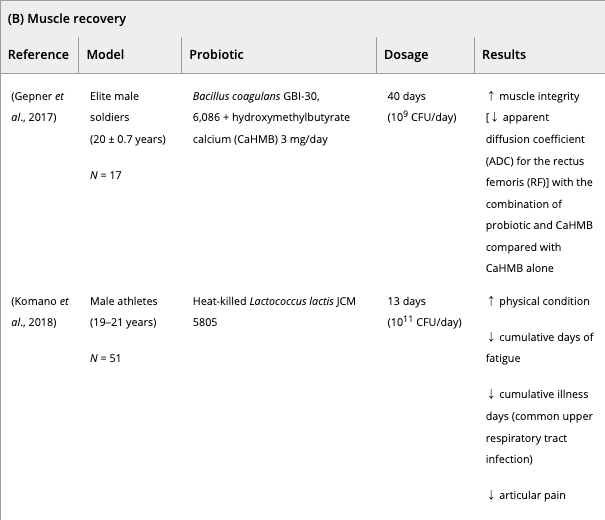
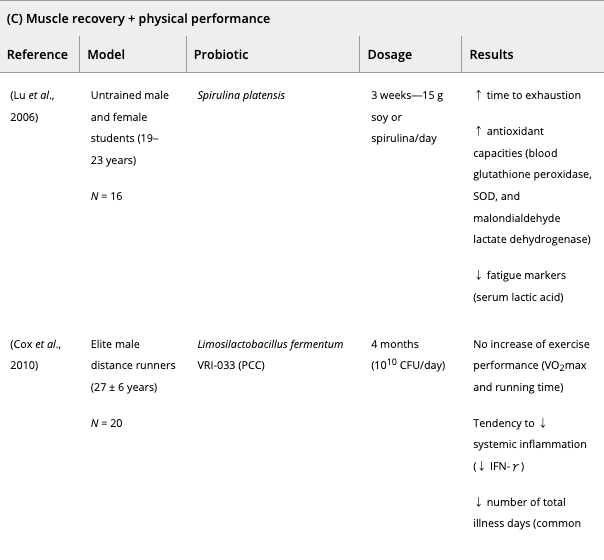
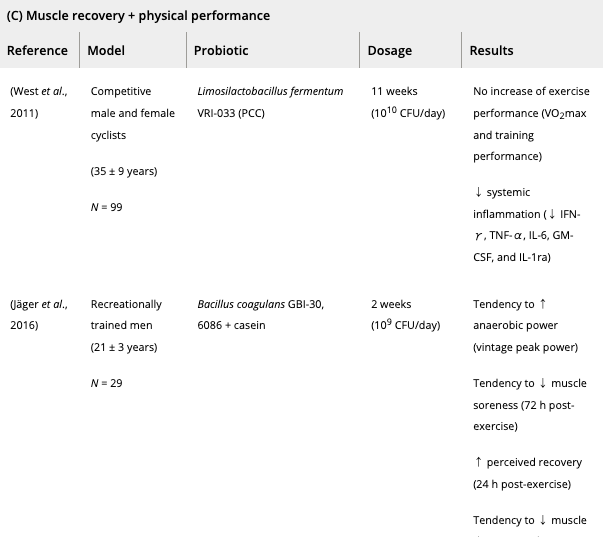
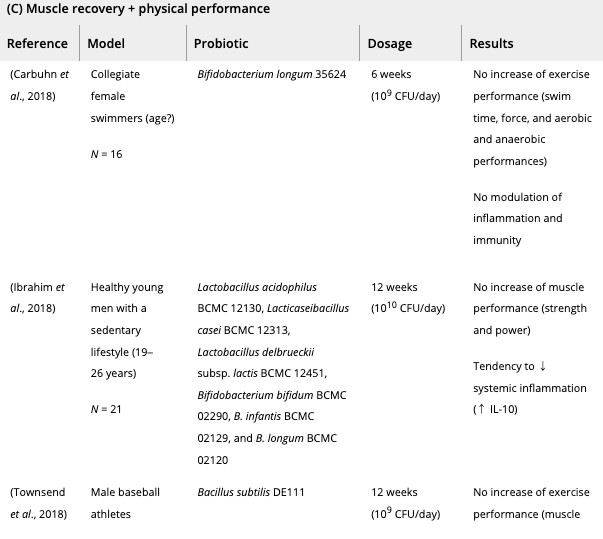
これまで、スポーツ選手や兵士へのプロバイオティクス補給は、
(i)筋パフォーマンス(走るスピードと疲労困憊するまでの時間、筋力とパワー)の改善
および/または
(ii) 激しいトレーニングの実践後の運動誘発性筋損傷の抑制
を目的に行われてきた。
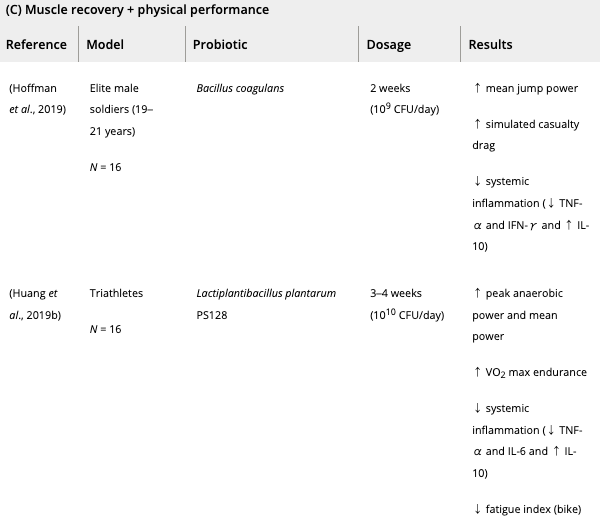
数種類のプロバイオティクス(スピルリナ・プラテンシス、ラクトバチルス・プランタルム、バチルス・コアグランス、マルチストレインプロバイオティクス)を2週間ほど補給したところ、プラセボ群と比較して持久力の改善が観察された。
並行して、エリート兵士の身体能力は2週間のバチルス・コアグランスサプリメントで改善された。
最後に、いくつかのプロバイオティクス株(アルスロスピラ・プラテンシス、バチルス・コアグランス、ラクトバチルス・プランタルム)は、筋疲労マーカー(例えば、クレアチンキナーゼおよび血清酸乳酸)を減少させることが示されており、運動後の筋回復を促進し得る。
結論と展望
現在までに、プロバイオティクス株(および株の混合物)は、アナボリックおよびカタボリックの両方の状況において、マウスの筋量および機能を向上させるのに効果的であることが証明されている。
ヒトに適用した場合、研究の少なさ、対象集団の多様性、筋量および筋機能を正確かつ繰り返し測定することの難しさなどから一貫した結論は得られていない。
あらゆる年齢層の個人または患者における筋機能を維持する最善の戦略の開発のためにさらなる研究が必要。