1800年代初頭に石灰岩の加熱によってカルシウムが発見されて以来、カルシウムのもつ多機能な役割が多くの研究によって明らかになっている。
カルシウムが持つ役割には化学プロセスにおける還元剤としての機能、骨における構造的特性、細胞内シグナル伝達などがある。カルシウムのシグナル伝達は細胞内または細胞間カルシウムイオン移動に関与し、細胞内外の膜間の電気化学的勾配、リガンド結合、酵素活性および細胞の運命を決定するその他のメカニズムに影響を与える。
筋肉では、カルシウムシグナル伝達は筋収縮に重要な役割を果たしている。
加齢とともに筋組織内に生じる変化であるサルコペニア、神経筋接合部の消失、ミネラル濃度の変化などは、すべてがカルシウムの役割に関連する。
最近注目されている研究分野である細胞老化は、加齢やカルシウムホメオスタシスの乱れと関連しており、サルコペニアの進行に影響を及ぼすと考えられている。
細胞老化は細胞の安定的な増殖停止であり、老化や加齢関連疾患と関連している。
老化細胞内では、代謝シフト、活性酸素種(ROS)の増加、細胞サイズの増大、ミトコンドリアの融合/分裂の変化、ミネラル濃度(鉄、カルシウム、亜鉛、マグネシウムなど)の変化、CDKN2A/CDKN1A/TP53などの細胞周期停止遺伝子の発現増加、老化関連分泌表現型(SASP)として知られる分泌物の増加など、多くの生理的変化が観察される。
様々な因子が細胞老化を誘導する可能性があり、一般的には細胞分裂の繰り返しや生物学的薬剤によるテロメアの短縮などDNA損傷に関連している。
しかし一方で老化細胞の全てが有害なわけではなく、初期発生や腫瘍形成の際の細胞停止に重要な用途もある。
カルシウム濃度は鉄などの他のミネラルとともに老化細胞で増加することが示されており、ミトコンドリア内に蓄積して機能障害を引き起こすなど有害な作用に関与している可能性がある。
カルシウムは単独では機能せず、近年解明されつつある複雑なミネラル同士の相互作用の一部である。
リンクのレビューは、カルシウムの生物学的重要性、現在の関連研究、公衆衛生上の意義、さらに鉄と亜鉛との関連性を取り上げたもの。
【レビューのまとめ】
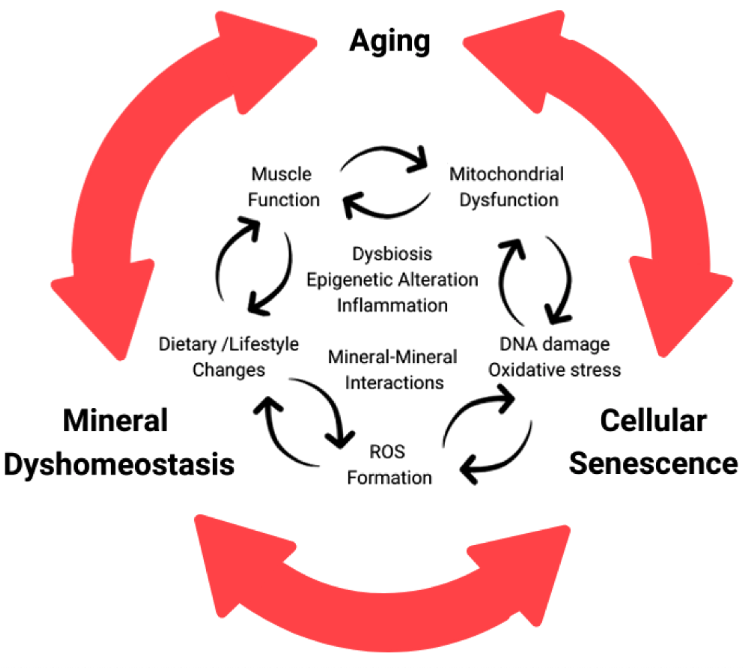
筋肉、老化した筋肉、細胞老化におけるカルシウムの調節メカニズムにおける様々な変化を観察した結果、その中には変化するものもあれば、不変のものもあった。
細胞内ではER/SR、ミトコンドリア、核など様々なオルガネラでカルシウム調節が行われており、これらの調節は加齢、細胞ストレス、細胞老化によって変化した。
筋肉老化と細胞老化におけるミネラル濃度の調節異常は、恒常性維持の異常サイクルによって引き起こされている可能性がある。このサイクルには炎症と細胞老化に向かって進行する老化の根本的なメカニズムが関与し、ミネラル濃度との相互作用の変化につながる。
ミネラル濃度との相互作用の変化はさらに負のサイクルを悪化させ、筋肉だけでなく老化した生体全体の他の様々な組織においても老化と老化関連疾患を進行させる。
Calcium’s Role and Signaling in Aging Muscle, Cellular Senescence, and Mineral Interactions
カルシウムシグナルと老化する筋肉
筋肉におけるカルシウムの役割
・カルシウムの移動と緩衝は細胞の恒常性を維持するために最も重要。カルシウム輸送体、チャネル、交換体、ポンプおよび結合タンパク質と緩衝タンパク質はすべてカルシウムの流れを調整するために制御されている。筋小胞体(SR)は骨格筋(SkM)の内部貯蔵カルシウム放出の主要制御システムとして、サルコメア内の局在によって2種類に分類される。縦型SRは収縮ユニットの周囲に位置して収縮と弛緩に関与し、接合型SRは横管として知られるサルコレマ侵入部に近接して位置して収縮を制御する。
・平滑筋細胞には筋原線維を形成するサルコメアがないため、平滑筋細胞のSRは一般的な細胞のERに似て配置が異なっている。心筋の核膜もER/SRと相互接続しており、カルシウム貯蔵システムとして機能している。心筋や骨格筋における規則正しく配列したアクトミオシン線維を含む筋線維は、電圧およびカルシウム依存性の興奮-収縮結合を介して収縮する。
・リアノジン受容体(RyR)、イノシトール-1,4,5三リン酸(IP3)、イノシトール-1,4,5三リン酸受容体(IP3R)、ジヒドロピリジン受容体(DHPR)、カルセケストリンやカルレティキュリンのようなカルシウムに対する結合親和性は低いが高い容量を持つ緩衝タンパク質、パルバルブミンやS100Gのような結合親和性の高いタンパク質、カルモジュリン(CaM)、トロポニンC、神経カルシウムセンサー(NCS)などのカルシウムセンサーなどのカルシウムシグナリングプレーヤーを包括的に理解することは、細胞恒常性の維持や筋生理学的プロセスにおけるカルシウムシグナリングの重要性を解明するのに役立つ。
・アクチンを含む細いフィラメントはカルシウムによって部分的にしか活性化されず、完全な活性化と協調には力を発生するミオシンモーターの結合が必要であることが報告されている。収縮中、カルシウムイオンは細いフィラメントを部分的に活性化し、アクチンに結合したモーターによって発生した力は太いフィラメントの折り畳まれたミオシンモーターの放出を誘発し、アクチンに結合したモーターの割合を増加させ、正のメカノセンシングフィードバックループを開始する。
これにより、より多くのミオシンモーターがアクチンに結合し、正のミオシン感知フィードバックループを引き起こし、力の発生を増加させる。
・心筋のトロポニンは、カルシウム結合サブユニットであるトロポニンC、抑制性サブユニットであるトロポニンI、トロポミオシン結合サブユニットであるトロポニンTの3つのサブユニットからなる。カルシウムがトロポニンCのN葉に結合するとtNiCの短いN末端部分がトロポニンCのN葉に結合するためトロポニンI(tNiC)のC末端から3分の1が解離する。これによってトロポミオシンがトロポニンTのN末端鎖と共にアクチンフィラメント表面を動き回り、トロポミオシンの頭と尻尾の結合部付近でミオシン頭部結合部位の一部が露出し、アクチン-ミオシン相互作用が促進される。トロポニンTのN末端側もアクチンフィラメントに結合し、トロポミオシンのシフトを制限している。カルシウムのない状態では、トロポニンはトロポミオシンの位置を保持してアクチンフィラメントへのミオシン頭部のアクセスを完全にブロックしている。カルシウムが結合すると、トロポミオシンはミオシン頭部へのアクセスを可能にする。
・カルシウムはSkMの成長に関与している。インスリン成長因子1(IGF1)は、PI3K-哺乳類ラパマイシン標的(mTOR)シグナル伝達軸をリクルートし、筋肥大や筋成長を促進する。IGF-1は、NFATを介する遺伝子発現の上流でIP3Rカルシウムシグナルを引き起こし、カルシウムと筋分化および筋成長の関係を支持する。
加齢が筋肉に及ぼす影響
・筋肉は加齢に伴って他の組織と同様の有害な変化を経験する。DNA損傷、ゲノムの不安定性、プロテオスタシスの喪失、ミトコンドリアの機能障害といった加齢関連の細胞事象が、加齢性損傷のイニシエーターと考えられる。老化した筋組織はその有糸分裂後の性質と分裂不能が特徴。分裂している細胞はテロメアが短縮しやすいので、静止している筋原繊維のテロメアは短縮から守られていると考えられる。にもかかわらず、成人の骨格組織ではテロメア短縮が見られるが、これは加齢に伴うフリーラジカルの増加が原因と考えられる。
・加齢に伴う筋肉量、筋力、機能低下はサルコペニアと呼ばれる。サルコペニア患者は運動能力に問題があり、転倒や骨折のリスクが高まり、座っている状態から立っている状態への移動など日常的な身体的作業を行う能力が損なわれる。サルコペニアは体脂肪の増加、インスリン抵抗性、免疫系の問題、がんなど、加齢関連の他の病気と併発することが多い。
・食事構成、食事パターン、ライフスタイル、運動習慣が加齢とともに変化しSkMに影響を及ぼす。筋肉の老化に伴い、速筋(タイプ2)の減少や脂肪沈着の増加も見られる。2つの線維タイプにおける若年者と高齢者のプロテオミクスの違いから、高齢者集団では速筋線維に比べて遅筋線維(タイプ1)の方が、タンパク質のホメオスタシス因子と糖質代謝の発現が増加することが明らかになった。また、両組織において加齢による酸化的リン酸化とミトコンドリア複合体タンパク質の減少が若い人と比べて観察されている。
・加齢によって細胞内では酸化ストレスに対する感受性が高まり、ミトコンドリア機能が低下し、タンパク質が修飾される。生体レベルでは炎症、免疫老化、老化細胞数の増加、同化ホルモンレベルの変化がみられる。これらの因子は分子レベルから組織、生体活動、合併症の問題にまで及び、加齢集団にみられる筋萎縮を引き起こす。
加齢によるカルシウムへの影響
・活動電位がシナプス前ニューロンを伝わると神経伝達物質とカルシウムがシナプス間隙に放出され、次にこれらの神経伝達物質は筋細胞内へ移動、T管を伝わりDHPR、RyR、IP3Rと相互作用してカルシウム放出と筋収縮を促す。これらのイベントを通してサルコレマは脱分極し、ニューロンからの活動電位が筋へと移動する。加齢に伴いそれら一連のカルシウム放出、神経伝達物質放出、シナプス小胞機能が低下し、RyRとDHRPの結合が解除される。
・電位依存性RyRカルシウム放出だけがSRカルシウム放出の唯一の方法ではなく、IP3Rもこのプロセスを促進する。SkMにおけるIP3Rと老化の関係を明らかにするための研究は限られているが、IP3Rは細胞の老化と長寿においてミトコンドリア内のカルシウム調節に起因する有害な作用と関連しており、これについては後述する。
・血清カルシウムと筋力低下を調べた縦断研究では、性別に関係なくカルシウム値が最も低い人は高い人よりも筋力低下が顕著だった。直接的な因果関係を明らかにするにはさらなる研究が必要でだが、カルシウム、筋収縮力、筋力低下、老化の相関関係は複数の生物に見られる。
・加齢は炎症、活性酸素、および前述のカルシウム調節異常の増加と関連していることから、活性酸素とカルシウムSRフラックスとの直接的な関係を調べるために老化モデルマウスでフルフェナム酸を使用した。フルフェナム酸は抗プロスタグランジン合成作用を持つ抗炎症剤で、TRPC、TRPM、TRPAなどのTRPチャネルのモジュレーター。フルフェナム酸の投与は年齢をマッチさせた対照と比較して、成体および高齢の時点(それぞれ12ヵ月および24ヵ月)で筋カルシウム濃度の低下を誘発した。加齢マウスの血漿では、IL-6やTNF-αなどの炎症マーカーも増加していた。活性酸素レベルの上昇も、治療に関係なく年齢の上昇と相関していた。しかし、成体マウスと若齢マウスを比較するとフルフェナム酸のレスキュー効果(ナトリウム/活性酸素/カルシウムの低下)が見られたのは若齢群のみで、高齢群ではレスキュー効果が得られなかった。フルフェナム酸の使用と中年期におけるそのレスキューは、TRPチャンネルと老化表現型の病因との関係の方向性を指し示している。
細胞老化
老化した筋肉と老化現象
・細胞老化では、ヒト線維芽細胞が数回継代すると増殖しなくなることが1900年代半ばに観察された。この複製誘導性老化はテロメアの短縮によって起こるが、がん遺伝子の活性化、酸化ストレス、DNA損傷、その他のストレス因子などの他の刺激によっても誘導される。
・老化は通常、p53、p16、p21などの細胞周期制御因子がサイクリン依存性キナーゼ複合体形成を阻害し、それによって細胞増殖を停止させる因子間の複雑なネットワークによって誘導される。
老化細胞の表現型は多様で、ミトコンドリア代謝の変化、細胞形態の変化、活性酸素種の産生、分泌表現型、クロマチンや遺伝子発現の変化などがある。
・老化したSkMでは、筋肉量の減少、インスリンシグナル伝達の変化、炎症などのが観察される。
老化したヒトとマウスのSkMの核をテロメア機能障害について調べたところ、γ-H2AXとテロメアの共局在が陽性だった核の割合が高く、テロメア損傷を示していることがわかった。SA-β-galは検出されなかったが、老齢SkMでは核内のHMGBIとラミンBIの消失とセントロメア長の増加が見られ、SkM細胞は加齢とともに老化しやすいことが示唆された。
・老化細胞を除去することで、加齢に伴う老化関連遺伝子の増加に対抗できることが確認されている。この老化細胞除去療法は握力を増加させたが、加齢に伴うSkM量と筋線維サイズの減少を変えることはできなかった。
・老化した筋肉では老化細胞がより多く存在し、傷害を受けた筋肉に長くとどまっていた。テロメア損傷反応は、若いマウスとは対照的に老齢マウスの再生筋でより大きかった。老化細胞の可視化と除去が可能なモデルであるp16-3MRマウスの若齢と老齢を、ガンシクロビル(GCV)で処理して老化細胞の存在を減少させたところ、老齢マウスの筋再生不全が回復し、炎症と線維化が抑制され、力の発生が促進された。このことは、老化細胞が老化マウスと若齢マウスの両方に有害な影響を及ぼすことを示唆している。
・慢性炎症によって自然に誘導される可能性がある慢性筋損傷では、SAβ-gal活性とp-16の増加が観察されたが、老化細胞溶解療法により再生筋線維のサイズが増大し、炎症が減少した。この発見により、急性損傷後に一過性に老化細胞が存在すると有益であるという古典的な、考えとは異なって軽度損傷でも慢性損傷でも筋における老化細胞の遮断は有益であると結論づけられた。
・GCV処理した幹細胞は、ビヒクル処理したマウスの幹細胞と比較して生体外で高い増殖能を示した。このことから、老化細胞は幹細胞の増殖を鈍らせる副次的な炎症性・線維化性SASP機能によって筋肉の再生を抑制していることが示唆された。
・細胞内カルシウム濃度の上昇は老化細胞の細胞質とミトコンドリアで観察されている。老化したヒト乳腺上皮細胞では、カルビンディン1カルシウム結合タンパク質(細胞質カルシウムを緩衝する)がアップレギュレートされていた。細胞内カルシウム濃度の上昇は、細胞膜からのカルシウム流入あるいは小胞体からの細胞内カルシウムストックによって引き起こされる。
ミトコンドリアの機能不全と老化
・ミトコンドリアはカルシウムイオンを貯蔵するが、これは不活性な関係ではない。カルシウムはミトコンドリア内でのATP産生に関与し、動的なフラックスを受けることが理解されている。
従って、老化細胞内ではミトコンドリアの機能不全とカルシウム濃度の増加が典型的であるが、おそらくこの2つの間には相互作用があると思われる。
・細胞老化はカルシウムフラックスの調節異常、ミトコンドリア膜の分極の変化、活性酸素の産生増加、アポトーシス機構に対する抵抗性によって特徴づけられる。これらのプロセスは通常、細胞複製を目的としているがマイトファジーにおいても役割を果たしている。
・ミトコンドリアの融合は小さなミトコンドリアから大きなミトコンドリアを生成するプロセスで、クレブスサイクル活性とATP産生の増加と関連する。融合は傷害を受けたミトコンドリアを健康なミトコンドリアと再結合させることで、ミトコンドリア機能不全を緩和する可能性がある。
細胞老化のプロセスの間、老化細胞のミトコンドリアはサイズ、体積および機能不全ミトコンドリアの数が増加する。
・カルシウム濃度はミトコンドリア機能と相互作用する可能性がある。通常、ミトコンドリアへのカルシウムの取り込みは主にミトコンドリアカルシウムユニポーター(MCU)を介して行われると考えられるが、LETM1(ロイシンジッパー-EF-ハンド含有膜貫通タンパク質1)のようなトランスポーターがミトコンドリアのカルシウム流入を仲介するカルシウム/水素アンチポーターとして働くことも支持されている。ミトコンドリアのナトリウム/カルシウム交換体は通常、ミトコンドリアからカルシウムを除去する働きをするが、ミトコンドリアが脱分極するとその逆の働きをすることが示唆されている。
・イノシトール1,4,5-三リン酸受容体2型(ITPR2)カルシウムチャネルは細胞のERとSRに存在し、ミトコンドリアとの接触とカルシウムの移動を促進する機能を持つ。ITPR2 KOマウスの研究では、WTマウスと比較してメスマウス(オスではない)の寿命が延びたが、WTオスはWTメスよりも長生きであることからITPR2がオスとメスの寿命差に寄与している可能性が示唆された。またKOマウスは細胞老化が抑制され、ミトコンドリアと細胞質小胞体の接触が減少した。逆に、合成リンカーを介してこれらの接触を増加させると早期老化が増加した。小胞体とミトコンドリアの接触は、ミトコンドリアのROS/p53と部分的にNF-kB依存性のSASPが関与する老化の引き金となる。この結果は、ミトコンドリアカルシウムの変化がエネルギー的変化につながり、細胞老化の一因となりうる活性酸素の産生増加経路の可能性を示唆している。
・真核細胞は過剰な活性酸素を処理するためのメカニズムを進化させてきた。その一つがスーパーオキシドジスムターゼ(SOD)を介したものである。SOD1には不均化反応を触媒する銅と亜鉛のサブユニットがあり、ミトコンドリアマトリックスに局在、SOD3は細胞外腔にある。
・特定の転写因子MondoAが細胞の老化防止に重要である。MondoAの発現は加齢とともに減少し、酸化還元シグナル伝達と細胞周期進行に関与する酵素的抗酸化ファミリーの一部であるPRDX3に影響を及ぼす。PRDX3はミトコンドリアに局在しており、MondoAをsiRNAで抑制するとミトコンドリア機能が低下する。
・ミトコンドリア、老化、筋肉の老化は関連づけられている。ミトコンドリアカルシウム取り込みノックアウトマウスモデルを介して、ミトコンドリア・カルシウム取り込みの調節異常が筋線維収縮力を低下させ、筋力低下に関連することが示された。老化とミトコンドリア機能障害、ミトコンドリア機能障害と筋ジストロフィーとの関係から、ミトコンドリアカルシウムと老化性筋表現型との関連が支持されるかもしれない。生物学的年齢の進行は、老化、低悪性度炎症、カルシウム調節異常を含むミトコンドリア機能障害を引き起こし、筋組織機能障害、調節異常、サルコペニアの進行を助ける。
ミネラル間のクロストーク
・カルシウムシグナル伝達を制御する様々な因子が亜鉛や鉄など他のミネラルによって影響を受ける可能性を考えると、他のミネラルが老化筋肉においてどのような役割を果たしているのか、またこれらの役割が細胞内のカルシウムの流れやカルシウムシグナル伝達関連タンパク質によって媒介されているのかを理解することは有益である。
・亜鉛は、構造的、酵素的、細胞内シグナル伝達など、複数の役割を担っている。亜鉛欠乏症は高齢者に多くみられ、免疫系機能に影響を及ぼす。全身的な亜鉛欠乏においても筋肉中亜鉛濃度はほぼ維持されるが、亜鉛欠乏は乳酸脱水素酵素などの金属酵素の活性を低下させる可能性がある。
対照的に、ミトコンドリアのグルタミン酸デヒドロゲナーゼの活性は欠乏中も変化しないことから、亜鉛欠乏がすべてのタンパク質に等しく影響するわけではないことが示唆される。
・高齢者において、亜鉛の補給は多次元疲労インベントリ(MFI)スコアを低下させる。MFIは身体的、精神的疲労、身体活動、意欲のレベルを5段階のリッカート尺度に基づく20の質問テストに基づいて評価するもの。このことは、特に欠乏症が蔓延しやすい高齢者集団では亜鉛補給が欠乏症による臓器系の横断的悪影響から保護する可能性があることを示唆している。
・老化細胞内では亜鉛濃度が細胞株によって5~8倍にも増加することが観察されており、若い細胞では500万個あたり0.176μg、老化線維芽細胞では0.725μgである。
・ヒト気管支上皮細胞に亜鉛を処理すると、p53/p21の高発現とともに細胞周期停止が引き起こされることがわかった。また、亜鉛は老化細胞のミトコンドリアで増加し、活性酸素産生の増加につながることが理解されている。亜鉛処理はNADPHオキシダーゼ活性とNF-kB活性化を誘導し、炎症を促進する。亜鉛濃度の調節異常がミトコンドリアの損傷と老化の表現型の加速につながると解釈されている。
・鉄はヘムとの関係や酸素運搬能力により体内で不可欠な役割を果たしている。しかし、鉄はフェントン反応によってヒドロキシルフリーラジカルを生成しやすい。これが制御されないとDNAやタンパク質の損傷、脂質過酸化を引き起こし、アポトーシスや老化などの細胞反応を引き起こす。鉄過剰負荷は、鉄誘導性細胞死経路であるフェロプターシスを増加させ、筋幹細胞の機能を損なうようだ。
・主要な鉄調節ホルモンはヘプシジンで、ヘプシジンは細胞鉄、循環トランスフェリン結合鉄、炎症によって調節される。ヘプシジンが増加すると腸管フェロポルティンが減少し、腸管細胞から血流への鉄放出が減少する。炎症はヘプシジン濃度を上昇させ、鉄吸収を変化させる。老化細胞内では様々な細胞モデルで鉄濃度が増加することが認められており、鉄濃度が20倍から50倍に増加するものもある。
・老化細胞における鉄の蓄積はミトコンドリア鉄濃度を増加させてさらなる損傷を引き起こし、老化の進行を支える細胞損傷の蓄積を引き起こす。
カルシウムチャネルおよびカルシウム結合/依存性タンパク質との相互作用
・細胞膜を介した亜鉛イオン(Zn2+)の移動は、亜鉛トランスポーターによって促進されるが、亜鉛はカルシウムチャネルを通しても輸送されることが確認されている。
電位依存性カルシウムチャネル(VGCC)を介した亜鉛の透過性は、マウスの筋管とラットの初代皮質培養において電位依存的にZn2+が遮断されることが観察されたことから示唆された。
このVGCCを介した亜鉛の侵入はカルシウムの存在下で起こる。
・VGCCの特定のサブタイプであるL型カルシウムチャネル(LTCC)は、Ca2+とZn2+の両方に共通する。無数のモデルでLTCCはZn2+の流入を引き起こすことが確認されている。LTCCアゴニストはZn2+の波を防ぐことが確認されている。
・一過性受容体電位タンパク質(TRP)は28種類の陽イオン透過性膜チャネルの一種で、非選択性陽イオンチャネルである。TRPM6とTRPM7は主にマグネシウムを輸送するが、カルシウムや亜鉛の伝達も行う。TRPM2は、主にアデノシン二リン酸リボースなどのヌクレオチド、酸化ストレス、カルシウム存在下などで活性化され、構造的完全性とチャネル活性に不可欠な保存的Zn2+結合ドメインを含む。リソソーム膜上のTRPM2はCa2+の上昇によって増強され、Zn2+の放出を誘発し、アポトーシスに至る有害なレベルまで上昇する。
・SOCEはカルシウム貯蔵量を補充する働きをする。ヒト唾液細胞およびラット顎下腺において、SOCEチャネルはZn2+によって阻害される。Zn2+はチャネルを透過することなくCa2+流入の競合的阻害剤として作用する。
・ウサギの単離骨格筋細胞において、亜鉛とカドミウムを含む陽イオンが骨格筋の痙攣を増強することが示唆された。カルシウムやマグネシウムから亜鉛やカドミウムへの陽イオンのシフトは、SRへの結合能が高いほど起こり、筋収縮の長時間活性化を誘導することが示唆された。
・亜鉛イオンは貯蔵カルシウムの放出を阻害することで、モルモットのカフェイン誘発筋収縮を延長させる。この知見に基づき、カルシウム貯蔵から細胞質にカルシウムを放出する機能を持つ心筋RyR2が標的であることが示唆された。実際、高濃度の亜鉛は心筋のRyR2上のリアノジン結合を減少させている。亜鉛がRyR2を介したカルシウム放出を制御するという考えは、RyR2が高親和性亜鉛結合阻害部位と低親和性亜鉛結合阻害部位の両方を持ち、心筋収縮におけるカルシウムホメオスタシスを調節していることも示唆している。
なんらかの疾患でお悩みの方で、より具体的な栄養マネジメントをお探しの方は当院の栄養マニュアル販売をご利用ください。
Lineまたはメールによるカウンセリングをもとに、皆様の症状や体質に合わせて摂取カロリー数の計算や、食事デザイン、サプリメントの選択、排除すべき食材などをパッケージでデザインし、ご提案いたします。
お気軽にお問い合わせください(お電話、LINE、インスタグラムのメッセージまたは連絡先、GOOGLEビジネスページのチャットをご利用いただけます)