多嚢胞性卵巣症候群(PCOS)は妊娠適齢期女性の3.6%から15%を占めるとされ(異なる診断基準を用いた異なる研究により)、多くのPCOS女性が過体重または肥満であると報告されている。肥満は内分泌障害や生殖機能障害を含む多くの疾患の危険因子となり、健康に悪影響を及ぼす。
肥満とPCOSの関連にはインスリン抵抗性、高インスリン血症のステロイド生成作用および生殖機能への作用、アディポカインの分泌、エネルギー消費量の変化、運動不足など様々なメカニズムが指摘されているが、PCOSの病因は依然として複雑で、完全には解明されていない。
興味深い研究に、ヒトおよび動物モデルにおいて、肥満-PCOS-腸内細菌叢異常の関連性を指摘したものがある。
この研究では、PCOS発症および進行における腸内細菌叢の役割が実証されている。
リンクのレビューは、プロバイオティクス/シンバイオティックサプリメントのホルモン・代謝プロファイルおよび炎症状態に対する有益な効果を検討することを目的としたもの。
プロバイオティクス/シンバイオティクスの摂取は、PCOSによって引き起こされるホルモンプロファイル、炎症指標、脂質代謝障害を改善する可能性がある。
Probiotics and Polycystic Ovary Syndrome: A Perspective for Management in Adolescents with Obesity
思春期の多嚢胞性卵巣症候群
PCOSは成人女性の5~10%、思春期女子の3.4~19.6%が罹患する内分泌代謝疾患。
正確な病態と病因はまだ不明で、環境的特徴、内分泌因子、遺伝的素因の複雑な相互作用が主な病因ではないかと疑われている。
社会経済水準、有害物質、ストレス、身体活動、食習慣などの環境因子もPCOS発症における重要な決定因子とされている。
ストレスは心理的ストレスや過食障害を誘発し、過食障害や肥満は視床下部-下垂体-性腺(HPG)軸のエピジェネティックな修飾や、アロマターゼを阻害する抗ミュラーホルモン(AMH)レベルの上昇により卵子形成に影響を及ぼし、高アンドロゲン血症につながる可能性がある。
PCOSの発症と症状には集合性があり、遺伝的素因の存在を示唆している。PCOSの母親の娘は、生涯にPCOSを発症するリスクが5倍高くなる。
PCOSの病態は、通常 “2ヒット説 “で説明される。”1つ目のヒット “は遺伝的素因に代表され、”2つ目のヒット “は引き金となる因子であり後天的なもの。
思春期のPCOSの管理は難しい
治療目的は、ホルモン状態と生活の質を改善し、合併症を予防すること。
PCOS少女の40~70%は過体重または肥満であることから、第一選択治療は食事と生活習慣の改善と減量。食事と生活習慣の改善による減量はアンドロゲンレベルと月経不順を減退させ、過体重の少女では代謝を増加させ、正常体重の少女ではメタボリックシンドロームの発症リスクを減少させることが実証されている。
多嚢胞性卵巣症候群と肥満
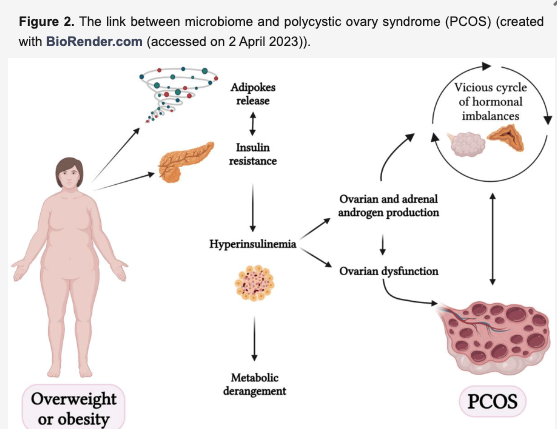
いくつかの研究でPCOSと肥満との間に強い相関関係が認められている。
米国ではPCOS女性の80%が過体重または肥満であることが観察されている。
他国でも同様のパターンが報告されており、PCOS女性の30%から50%が肥満である。
思春期のPCOS患者では30%から40%が過体重または肥満。
脂肪組織は活発な内分泌器官としてアディポカインを産生・放出し、アディポカインは炎症促進作用(レプチン、レジスチン、オステオポンチン、インターロイキン(IL)-6および-10、腫瘍壊死因子(TNF-α)など)と抗炎症作用(アディポネクチンやオメンチンなど)の両方に関与している。これらのアディポカインはエネルギー代謝、食欲調節、インスリン感受性、炎症、アテローム性動脈硬化症、生殖機能の調節に重要な役割を果たしている。
特にアディポネクチンは主に白色脂肪組織で合成・放出されるアディポカインで、皮下脂肪に比べて内臓脂肪で高産生・分泌を示し、抗炎症作用、抗アテローム作用、インスリン感作作用があり、生殖機能の調節に関与している。
肥満は高インスリン血症、高脂血症、高レプチン血症、および慢性的な低悪性度炎症状態を引き起こし、マクロファージによる浸潤によって特徴づけられる。活性化されたマクロファージはインスリン抵抗性の発現に寄与する可能性がある。
PCOS女性は顕著なインスリン抵抗性(IR)を呈し、PCOSの病因において極めて重要であると思われる。
思春期のPCOS女性ではIRと高インスリン血症が認められるが、思春期自体が生理的IRと関連していることを考慮する必要がある。肥満は思春期のPCOS患者のIRにさらなる影響を与え、代謝異常と生殖異常を悪化させる。
PCOSとIRを有する女性は、IRを有さないPCOSの女性に比べて一般的にBMIが高く、内臓脂肪分布が大きく、アンドロゲン値が上昇し、多毛症、にきび、排卵機能不全などのPCOSの症状がより重篤である。
インスリンの役割は、代謝過程だけでなく、卵巣生理や病態生理にまで及んでいる。
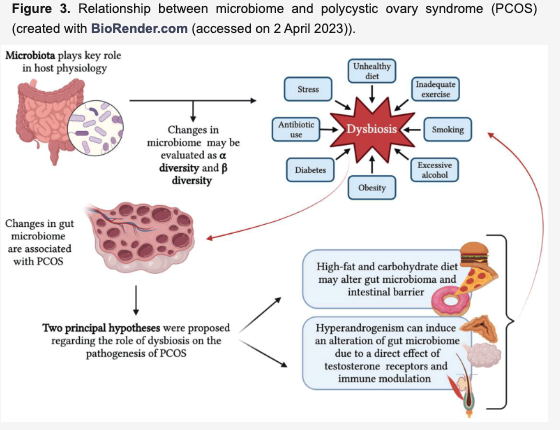
ディスバイオーシスと多嚢胞性卵巣症候群
腸内細菌叢は宿主生理、免疫調節、消化管上皮バリア機能、内分泌系、宿主代謝、発酵を介したビタミンB12や短鎖脂肪酸(SCFA)の産生、神経機能において重要な役割を果たしている。
バクテロイデーテス(Bacteroidetes)、ファーミキューテス(Firmicutes)、アクチノバクテリア(Actinobacteria)、プロテオバクテリア(Proteobacteria)が最も一般的な4つの細菌門で、生活習慣、環境中の化学物質への曝露、年齢、抗生物質の使用、ストレス、食生活の変化といった要因によって影響を受ける。
腸内細菌叢の変化はディスバイオーシスと呼ばれ、自己免疫疾患、神経疾患、心血管疾患、PCOSを含む代謝障害と関連する。ディスバイオーシスとPCOSの関連性は2012年に初めて提唱され、16年と17年にも腸内細菌叢の変化がマウスモデルとヒト女性の両方でPCOSと関連していることが提唱されている。いくつかの研究でPCOS患者の微生物叢と対照群の微生物叢が比較され、消化管マイクロバイオーム組成の変化やディスバイオーシスがPCOS発症に重要な役割を果たしている可能性が示されている。これらの研究の知見で一貫しているのは、対照群と比較してPCOS群で観察されるα多様性の減少。α多様性の低下はPCOS女性で一般的に観察されるが、原因因子として特定の細菌は同定されていない。
いくつかの研究結果は、プレボテラや大腸菌、リポ多糖(LPS)を産生するグラム陰性菌など、粘膜の炎症や炎症性サイトカインおよびケモカインの産生に関連する菌種の拡大を示唆している。
PCOSの病因におけるディスバイオーシスの役割については2つの仮説が提唱されている。
一つは、高脂肪・高炭水化物食が腸上皮バリアを変化させることで腸管バリアの破壊と毒素や抗原の血流への移行を引き起こし、免疫系の亢進を誘導する可能性。
二つ目のメカニズムは、エネルギー吸収の促進、短鎖脂肪酸代謝への潜在的影響、グルコースや脂質代謝、炎症に影響する胆汁酸代謝の変化、コリン代謝経路への影響、腸-脳軸に関与する消化管ホルモンの調節などが含まれる。
PCOSの病因に関与する経路は多様で現在の知見はまだ限られているが、予備的知見ではPCOSの病因におけるディスバイオーシスの役割は支持されている。
各個人の遺伝的、食事的、環境的、微生物叢的特徴によってメカニズム的経路は複数に渡るのかもしれない。
実際にディスバイオシス理論によれば、プレバイオティクス、プロバイオティクス、シンバイオティクスを治療オプションとして利用することは、PCOSの生化学的および臨床的特徴を改善する上で有望である。
ラットを用いた包括的研究では、既存の腸内細菌叢を除去するために抗生物質処理によって擬似無生殖ラットが作製され、このラットに糞便微生物叢移植(FMT)を行った。
興味深いことに、FMTによるdysbiosisの誘導に加えて、これらのラットにおいて内分泌学的および代謝学的PCOS表現型の発生が観察された。これらの表現型はグルコースと脂質代謝の障害、発情周期の乱れ、多嚢胞性卵巣の存在、生殖ホルモンの変化によって特徴付けられた。この結果は、ディスバイオーシスが高アンドロゲン血症を経て、視床下部-下垂体-副腎(HPA)および視床下部-下垂体-卵巣(HPO)軸の障害を介して代謝および内分泌のホメオスタシスを乱す可能性を強く示唆している。
プロバイオティクスと多嚢胞性卵巣症候群(PCOS)
PCOSと腸内細菌叢の変化との関係を探る研究がいくつか行われている。
研究結果は、PCOSと診断された女性の腸内細菌叢は、PCOSでない女性と比較して多様性が低いという特徴を示している。このαおよびβ微生物の多様性の低下は高アンドロゲン血症および全身性炎症レベルの上昇と関連する。PCOSで観察される微生物多様性の低下は、乳酸菌やビフィズス菌のような有益な細菌の減少によって特徴づけられることが多いが、逆に大腸菌や赤痢菌などの病原性細菌が増加することも多い。また、特定の細菌種、特にバクテロイデーテス属とファーミキューテス属のバランスが変化することで短鎖脂肪酸の産生が変化し、代謝、腸管バリアーの完全性、免疫に悪影響を及ぼすことも観察されている。
腸内細菌異常症は炎症と腸粘膜透過性の変化の根本的な原因であると考えられ、PCOS女性は腸管透過性が高いという証拠もある。
PCOSマネジメントにおいて、プロバイオティクスは治療のための有望な選択肢と考えられる。プロバイオティクスは発酵食品に自然に存在し、代謝パラメーターを改善し、腸内細菌叢組成を調節し、免疫系を調節するとともに、抗酸化性、抗菌性、抗炎症性を示す。
プロバイオティクスとして最も一般的に利用されている細菌属は、ラクトバチルス属、バチルス属、ビフィドバクテリウム属、ストレプトコッカス属、エンテロコッカス属。
プロバイオティクスサプリメントは、PCOS患者の代謝プロファイルを改善することが実証されている。2022年には、プロバイオティクスサプリメントがホルモンおよび炎症マーカーの調節に有意な影響を及ぼし、遊離アンドロゲン指数およびマロンジアルデヒドの有意な減少、SHBGおよび一酸化窒素の増加、PCOS患者の体重、BMI、インスリン、HOMA-IR、多毛症、総テストステロンの改善が示され、他の研究やメタ解析でもこれらの所見が確認されている。
上記の有益ば影響を示した菌株は、ビフィドバクテリウム・ラクティス、ラクトバチルス・アシドフィルス、ラクトバチルス・パラカゼイ、ラクトバチルス・プランタラム、ラクトバチルス・サリバリウス、ラクトバチルス・ラクティスなどのラクトバチルス門が多い。
プレバイオティクスにはフラクトオリゴ糖とイヌリンが含まれていた。
まとめ
PCOSは肥満関連疾患で、その影響は肥満によって大きく増幅される。
近年、PCOSにおけるプロバイオティクス/シンバイオティクスの有効性が支持されており、プロバイオティクス/シンバイオティクスの補充はPCOSに関連するホルモンプロファイル、炎症指標、脂質代謝障害を改善する可能性がある。
また、体重、BMI、インスリン、HOMA-IRの改善も示しており、生殖能力を保護する潜在的な役割を示している。
プロバイオティクスの補充は、肥満少女のPCOSを管理するための選択肢となりうる。
小児期から少女期にかけての早期プロバイオティクスの補充は、PCOSの修正可能な原因としてのディスバイオーシスを予防、調節するのに有効と考えられる。