本日のブログは、2種類のヒト乳オリゴ糖(HMO)を添加したアミノ酸ベースミルク(AAF)が、牛乳タンパク質アレルギー(CMPA)乳児において正常な成長をサポートし、忍容性が高いかどうかを評価した試験をまとめてみたい。
乳児期のCMPAでは、ビフィズス菌が抑制され、プロテオバクテリアやその他のグラム陰性腸内細菌が濃縮されることを特徴とする腸内細菌異常(ディスバイオーシス)に関連しているとされる。
いくつかの研究で、ビフィズス菌は感染症から身を守るための自然免疫および適応免疫の増強など、早期の免疫成熟を促進することが証明されている。
乳児期における健全な腸内細菌叢の確立には、乳児期のビフィズス菌種やバクテロイデス類に好ましい基質を提供するヒトミルクオリゴ糖(HMO)の存在が必要。
この試験では中等度から重度のCMPAを持つ生後1~8ヵ月の成育期の32人の乳児を対象に、2′-フコシラクトース(2′-FL)とラクト-N-ネオテトラオース(LNnT)を加えたAAを4ヶ月間与え、生後12ヶ月までそのミルクを継続。
試験期間中、忍容性と安全性が評価された。
4ヶ月の試験期間中、体重対年齢Zスコア(WAZ)の平均値は、ベースラインの-0.31から4ヶ月後のフォローアップでは+0.28に増加。
線形成長および頭部成長も同様に小さな上昇傾向を示した。
このフォーミュラは忍容性が高く、優れた安全性プロファイルを有していた。
ベースラインとその後のマイクロバイオームを比較すると、HMO利用ビフィズス菌の有意な濃縮が見られ、糞便中の短鎖脂肪酸の有意な増加と関連していた。
さらに、糞便中のProteobacteriaの存在量の有意な減少を観察。
HMOを補充した試験用ミルクが、CMPAを有する乳児の腸内細菌ディスバイオーシスを部分的に修正することが示唆された。
・この試験における平均体重増加量は18g/日で、以前に行われた健康な乳児を対象とした同じAAF(HMOなし)の成長試験よりも低い。この差は、CMPAを発症した乳児の登録年齢が高いこと、およびCMPAの影響による二次的な成長遅延の可能性に起因すると考えられる。
・この研究に登録された乳児は様々な症状を呈し、そのほとんどが非IgE介在性CMPAを示唆した。ほとんどの参加者は、EHFまたは加水分解米粉による前治療が無効だった。
・親からの報告および医師による評価によると、登録から面会1回目までに症状は著しく改善し、その後の面会でも症状のさらなる改善が観察された。皮膚症状のコントロールは概ね良好で、V5まで皮膚症状が持続した乳児は1名のみだった。
・副次的成果として、登録時から生後12カ月までのマイクロバイオーム組成および糞便中SCFA濃度の変化を評価した。腸内細菌叢の早期発達は、出生方法、食事、環境要因に影響される非常に動的なプロセスだが、生後1年間のマイクロバイオーム発達に影響を与える最も重要な要因は圧倒的に授乳の種類で、母乳栄養児は粉ミルク栄養児と比較してマイクロバイオームおよびメタボロームが著しく異なる。
生後数カ月は、母乳中のHMOが乳児型ビフィズス菌に富む腸内細菌叢を構築するための特異的基質となる。
・ビフィズス菌は嫌気性環境を作り出し、ビフィズス菌の腸内コロニー形成は初期免疫の発達に大きな恩恵をもたらす。
・いくつかのHMO菌種は糖鎖結合および粘膜接着を妨害することで、呼吸器および胃腸の感染に対して保護効果を与えることが示されている。
・幼児期におけるビフィズス菌の不足とプロテオバクテリアおよびその他のグラム陰性菌の過剰増殖は、「ディスバイオシス」とも呼ばれ、幼児期以降に喘息やアレルギーの素因になると考えられている。
HMOの補給は潜在的にビフィズス菌の豊富さを回復させ、ディスバイオシスのマイクロバイオームの影響に対抗する可能性がある。
・ビフィズス菌の豊富さの回復は、アトピー症状のリスク低減を含む健康上の利益と関連する可能性がある。
・今回の試験では、ベースライン時の乳児の腸内細菌叢はビフィズス菌が相対的に不足し、プロテオバクテリアやその他のグラム陰性菌が過剰増殖しており、ディスバイオシスの特徴を呈していた。
しかし、試験食への変更後、V1ではHMO資化性ビフィズス菌、B. breve、B. bifidum、B. longum subsp. infantis、B. longum subsp. longumが有意に増加。
この増加は主にHMO利用性ビフィズス菌に見られ、試験飼料中の2′-FLとLNnTの特異的な作用が示唆された。
・B. pseudocatenolatumおよびB. catenulatum subsp.kashiwanohenseもV1、V4およびV5で有意に濃縮されたが、これらのHMO資化性ビフィズス菌の増加はV5で最も強く、HMOとAFFの混合効果を示唆した。
・ビフィズス菌は酢酸などのSCFAを産生して大腸の pH を低下させ、腸内病原体に対して酸性の保護環境を作り出す。今回、V0から V5にかけて糞便中SCFAが全体的に増加した。
糞便中のSCFAは腸粘膜の健全性、および大腸制御性T細胞のホメオスタシスを改善することが示されている。
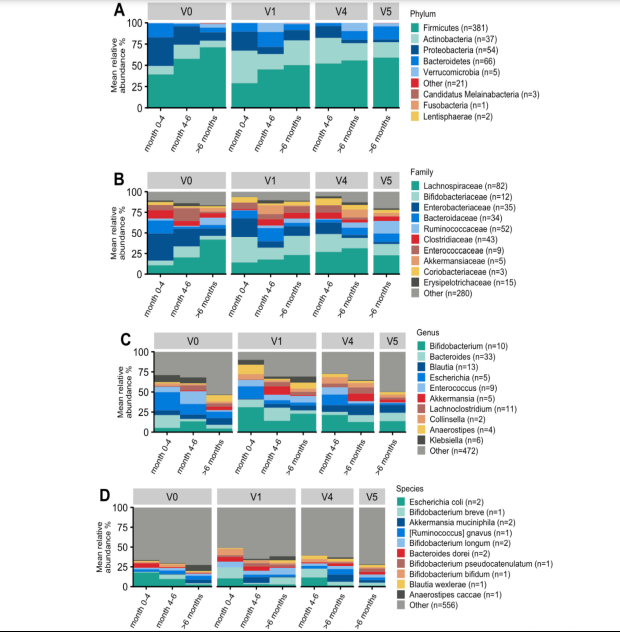
棒グラフは最も高い存在度の上位10分類群の平均相対存在度。
灰色(その他)は、分類できたが上位10種に含まれないメタゲノム種の相対現存量の合計を示す。
括弧内は集計された分類群に含まれるメタゲノム種の数を示す。
・HMO資化性ビフィズス菌は芳香族乳酸脱水素酵素(ALDH)という酵素を発現し、芳香族アミノ酸から芳香族乳酸(インドール酢酸、フェニル乳酸、4-ヒドロキシフェニル乳酸)を生産する。
芳香族乳酸は腸管バリア機能の改善、病原性感染症からの保護、代謝経路への影響など臨床的に大きな利益をもたらすと考えられている。
・さらに有益な効果には、Tヘルパー2(Th2)細胞およびTh17細胞における免疫調節性のガレクチン-1の誘導が含まれ、これはアレルギー感作に対するHMO資化性ビフィズス菌の保護作用を示唆している。したがって、HMOの補充とHMO資化性ビフィズス菌の増加がアレルギーの転帰に正の影響を及ぼすことは理にかなっている。
・今回、健康な腸内細菌叢への移行を示す他の有意な細菌種の変化も見出した。
全体として、Proteobacteriaの存在量はV0からV1にかけて減少し、CMPAやその他のアレルギーを持つ乳児に典型的に見られるディスバイオージスが部分的に是正されたことが示唆された。
V0から1歳末までのBacteroidesの著しい増加は、Bacteroidesが食物繊維の大腸内分解に重要な役割を果たし、成人型腸内細菌叢への健全な移行の典型例。
粘液分解に関連する機能的重要性をもつグラム陰性菌のAkkermansia muciniphila は、ベースラインと比較してV4とV5で濃縮されていた。Akkermansia muciniphilaは2′-FLや他のHMOを利用できることが確認されている。
・酪酸産生菌の出現に伴い、生後12ヶ月にかけて糞便中の酪酸濃度が上昇することが確認された。
糞便中の酪酸は腸の健康と免疫調節に重要で、非IgE介在性CMPAの乳児では減少している。
結論
中等症から重症のCMPA乳児に2種類のHMOを含む試験用ミルクを与えたところ、十分な成長が得られた。このフォーミュラは良好な耐容性を示し、優れた安全性プロファイルを有していた。
HMO資化性ビフィズス菌が早期に有意に増加し、1年目の後半にBacteroidesおよび酪酸産生菌が増加することが実証された。
逆に、腸内環境の悪化の指標となるプロテオバクテリアは有意に減少した。
マイクロバイオームの変化は、登録時から生後12カ月までの糞便中SCFA濃度の有意な上昇と関連していた。
これらの知見は、2’-FLおよびLNnTの補充が、HMO利用ビフィズス菌の有意な濃縮とCMPA乳児における腸内細菌性ディスバイオージスの一部是正に関連していることを示唆している。