新生児の腸内マイクロバイオームの形成は、将来の健康状態と維持に重要な役割を果たす。
新生児の腸内細菌叢の構成は、正期産か早産か、経膣分娩か帝王切開か、新生児への栄養(母乳か人工乳か、母親のケアか新生児集中治療室(NICU)か等の条件と密接に関連している。
新生児はまず、母親のマイクロバイオームコミュニティにさらされる。
新生児の腸内細菌叢は一時的にブドウ球菌科や腸内細菌科が優勢となるが、その後ビフィズス菌が優勢になる。乳児の腸内ビフィズス菌レベルが高いほど、小児感染症、アトピー性疾患、肥満のリスクが低いことはよく知られている。
離乳後、乳児の腸内細菌叢はビフィズス菌優位のものから成人の細菌叢に近い組成に移行するが
この細菌叢組成の変化に影響を与える重要な要因は、補完食の導入よりもむしろ母乳育児の停止。3歳までに、Bacteroides、Prevotella、Ruminococcusに分類される安定した成人型腸内細菌叢が獲得される。
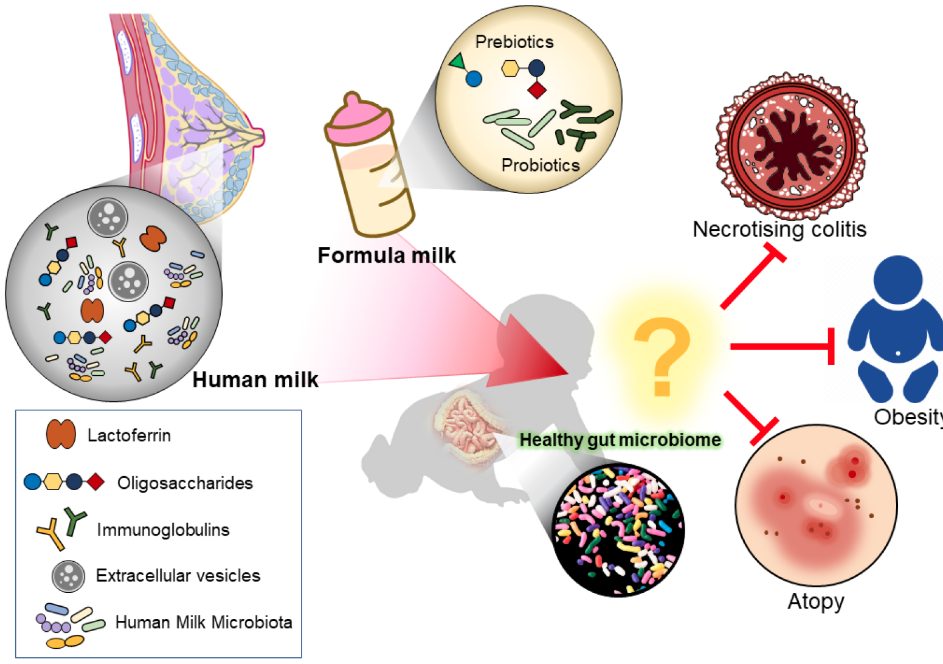
生後間もなく、乳児は母乳または粉ミルクを与えられる。
母乳には乳児の腸内細菌叢の形成に貢献し、感染予防や免疫調節に関与する善玉菌が含まれている。
母乳には乳児の最適な成長のための栄養要求を満たす必須栄養素がすべて含まれていることに加え、生理活性成分-オリゴ糖、免疫グロブリン、ホルモン、成長因子、サイトカイン、ケモカイン-も含まれており、腸内細菌叢と免疫系の発達、および腸粘膜バリア機能の維持に重要な役割を担っている。
しかし、母乳で育てられない場合、あるいは(健康上の理由で)母親から乳をもらってはいけない場合には、微量栄養素や多量栄養素を含んだ粉ミルクが与えられる。
リンクのレビューは、母乳と粉ミルクが乳児の腸と健康に及ぼす影響について考察したもの。
Exploring the Potential of Human Milk and Formula Milk on Infants’ Gut and Health
*乳幼児の腸に影響を与える要因
・分娩様式
分娩様式、妊娠年齢、乳児の食事、抗生物質の使用、乳児の入院といった多くの変数が乳児の腸内細菌叢の発達に影響する。
乳児の腸に最初にコロニーを作る微生物は母親からのもので、経膣分娩の場合は母親の膣内微生物叢からのものとなる。
出生直後の乳児から採取した細菌を母親の異なる身体部位から採取したサンプルと比較した研究では、すべての乳児が似たようなマイクロバイオーム構成を共有していることが明らかになっている。
生後3週間の経膣分娩新生児は、母親の膣内マイクロバイオームに曝露され、Bifidobacterium、Escherichia、Lactobacillus、Bacteroides種に富んでいる。
一方、帝王切開で生まれた赤ちゃんは両親の皮膚マイクロバイオーム種にさらされ、病院環境由来の種がコロニー化している可能性がある。
帝王切開で生まれた赤ちゃんは、Enterobacter、S. epidermidis、K. pneumoniae、E. coli、Klebsiellaが豊富な腸を有している。
またある研究では、経膣分娩の初期には乳児の腸内はラクトバチルスに富み、その後2週目にはバクテロイデスが増加することがわかった。これらの微生物パターンは、帝王切開で生まれた乳児では観察されなかったことから、分娩形態は乳児の腸内細菌叢を豊かにする上で重要な役割を担っていることがわかる。
出生形態が腸内細菌叢形成と多様性に及ぼす影響は、年齢とともに減少するものの生後6ヶ月間は最も顕著である。
・妊娠月齢と抗生物質の投与
出生時の妊娠期間も、新生児の腸内細菌叢の発達に欠かせない要素。
妊娠22週から36週頃に生まれた早産児の腸は、成熟児(妊娠37週から42週)よりも透過性が高い。
また早産児では、BifidobacteriumとBacteroidetesの存在量が少なく、Enterobacteriaceae、Enterococcaceae、Lactobacillaceaeの存在量が多いことが成熟児と比較して観察されている。
これは、入院中の早産児が母乳育児によって正期産児と同様の正常な腸内細菌叢を獲得するのに役立つ可能性があることを示唆している。
周産期の抗生物質の使用は腸内細菌の多様性と安定性の低下によって示し、腸内細菌組成に影響を与える。
周産期に抗生物質にさらされた乳児と抗生物質にさらされなかった乳児の腸内細菌のコロニー形成を比較した研究では、曝露群と対照群の腸内細菌叢の差は生後6カ月時点でも持続し、その差はプロバイオティクスであるLactobacillus reuteriを摂取しても防げないと報告。
B群溶血性レンサ球菌の抗生物質治療により、満期産児ではビフィズス菌の生息数が減少することが研究で示された。
その他の細菌群(Lactobacillus sp.、Bacteroides fragilis、Clostridium difficile)には影響がなかった。
・授乳形態
乳児の腸内細菌のコロニー形成と組成に影響を与えるもう一つの重要な要因は、乳児への授乳形態。
乳児用粉ミルクは可能な限り母乳に似せて作られているが、母乳栄養児と粉ミルク栄養児の腸内細菌叢の構成は異なる。
いくつかの研究で、前述の様々な周産期要因によって乱れたマイクロバイオームに対して母乳は有益な効果をもたらすことが実証されている。
母乳栄養の正期産児では、ビフィドバクテリウムが豊富だが、粉ミルク栄養の乳児では腸内細菌科、バクテロイデス科、クロストリジウム科の増加が観察されている。
・母乳の成分
母乳の栄養成分は、大栄養素(炭水化物、タンパク質、脂肪)と微量栄養素(ミネラル、ビタミン)に分類される。
母乳には二糖類である乳糖が約7.0%含まれ、乳糖は母乳の総エネルギーの40%に相当する。
母乳に含まれるオリゴ糖は非栄養性で難消化性だが、乳児の腸内細菌叢の発達に重要な役割を担っている。
母乳中のタンパク質含有量は0.9%~1.2%と推定。
約30%はカゼイン、70%は主にラクトフェリン、α-ラクトアルブミン、分泌型IgAからなる乳清タンパク質。
成熟乳の平均脂肪濃度は約3.8%で、ヒトの乳から得られる総エネルギーの約半分。
母乳の組成は動的で、赤ちゃんの必要性に応じて変化する。
ある研究によると、母乳は大栄養素、特にタンパク質と脂肪組成は著しい日内変動を示し、その日内変動は未熟児の母親の母乳でより顕著であることが分かった。
また、前乳に比べて後乳では脂肪やエネルギー含有量が多くなる。
いくつかの研究で、早産児の母乳は経産婦の母乳に比べ、炭水化物、タンパク質、脂肪、エネルギー含量が高いことが示されている
・オリゴ糖
ヒト乳オリゴ糖(HMO)は、ヒト乳成分中3番目に多く、約0.8-1.4%存在する。
HMOの濃度は泌乳の段階によって異なり、泌乳が進むにつれて減少する。
また早産児の母親の母乳中には、経産婦の母親よりも高いレベルのHMOが検出される。
HMOは乳児には消化できないが、プレバイオティクス効果があり、特定の腸内細菌によって代謝されて乳児の腸内での増殖とコロニー形成を促進する。
数週間母乳を与えた後では、乳児の腸内細菌叢が非HMO利用菌からHMO利用菌にシフトすることを実証した研究もある。HMO利用菌の増加とともに糞便中のHMOが減少しており、腸内細菌によるHMOの利用が確認された。
BifidobacteriaやBacteroides株はHMOを代謝し、エネルギー源として利用する能力が高い。
一方、Enterococcus、Clostridium、Escherichia coli、Staphylococcus、Streptococcusなどの種は、HMOsの代謝が非効率的である。
潜在的な病原体よりも有益な細菌の増殖を選択的に促進することから、HMOは感染症の予防に役立つと考えられている。
さらに、腸内細菌によるオリゴ糖発酵は酢酸などの短鎖脂肪酸(SCFA)や乳酸などの有機酸を産生し、腸内細菌の増殖を抑制し栄養分の吸収を促進する低pH環境を発生させることが分かっている。
HMO上で増殖したBifidobacteriumは、抗炎症性サイトカインの増加や炎症性遺伝子の発現を低下させることから、HMOの増殖が抗炎症作用を有することが示唆されています。
HMOはBifidobacterium infantisの腸管上皮への付着能力を調節・増強することが示されており、同菌のコロニー形成能力を高める。
さらに、HMOは潜在的な病原体に対して抗接着性を発揮する。
いくつかのHMOがCampylobacter jejuni、Clostridium butyricum、Escherichia coli、Pseudomonas aeruginosaおよびNorovirusの上皮細胞への接着レベルを低下させることを実証した研究がいくつかある。
・ラクトフェリン
ラクトフェリンは鉄結合タンパク質で、母乳中に存在する必須生理活性因子の1つ。
濃度は泌乳期間を通じて変化し、初乳で最も高く、その後の乳汁で減少し、成熟乳で比較的一定の濃度に達する。
母乳栄養児の糞便ラクトフェリンレベルがヒト乳中のラクトフェリンレベルと有意に関連していたことが明らかになったことから、母乳が乳児の腸内ラクトフェリンの主要な供給源であることが立証されている。
ラクトフェリンレベルは粉ミルクよりも母乳で高く、ヒトラクトフェリンは病原体の増殖を防ぐのに高い効果を示すことも報告されている。グラム陽性菌とグラム陰性菌の両方に対して抗菌作用を示すことが示された。
他の研究では、ラクトフェリンが黄色ブドウ球菌、リステリア菌、サルモネラ菌、大腸菌などの病原性細菌の増殖を抑制する能力を持つことが実証された。Lactobacillusなどのプロバイオティクス細菌の発育には影響を与えなかった。
さらに最近の研究では、ラクトフェリンは病原体が形成するバイオフィルムを除去し、微生物と腸管上皮の相互作用を防ぐことが明らかになっている。
・免疫グロブリン
免疫グロブリン(Ig)は、新生児に受動的な免疫学的保護を提供する母乳中の生物活性因子で、IgG抗体は胎盤を通過するため子宮内の胎児および出生後の乳児に受動的な免疫力を提供する。
IgAおよびIgMは胎盤を通過することができない。乳児は出生時には自身のIgAレベルが非常に低く、免疫システムが発達する生後数ヵ月間徐々に上昇することから分泌型IgAの供給源として母乳は重要。
母乳育児の実践は、母乳中の免疫グロブリン濃度にも影響を与える可能性がある。
母乳のみを与えている母親の母乳中のIgG濃度は、母乳のみを与えていない母親と比較して高いことが証明されており、最初の6カ月間は母乳のみを与えるというWHOの勧告を裏付けている。
母乳中のIgAと総タンパク質濃度は授乳1年目以降に上昇することが分かっており、食物を導入した後でも母乳育児は子どもに栄養学的、免疫学的な利益をもたらすことが示されている。
したがって、母子の好みに合わせて授乳期間を延長することが推奨される。
IgAは、BacteroidesやBifidobacterium、Lactobacillusなどのプロバイオティクス株が腸管上皮に付着する能力を高め、健全な腸内細菌叢の確立に寄与している。
母乳からの分泌型IgA不足は、腸内細菌叢や腸上皮の遺伝子発現の変化と関連しており、その結果、後年腸の炎症にかかりやすくなる可能性がある。
・母乳微生物叢
母乳には多様な微生物集団が存在し、微生物組成は母親によってかなり異なる。
最近の研究では、母乳中に392の属が検出されている。
生後1ヶ月の母乳栄養児(1日の乳汁摂取量の75%以上が母乳)では、腸内細菌叢の約40%が母乳と乳輪皮膚に由来することから、細菌源としてのヒトミルクの重要性と乳児腸内細菌叢を決定する上での意義が強調されている。
いくつかの研究で、出産形態、妊娠年齢、授乳期、母乳育児の実践などの要因が、母乳の微生物組成の決定に関与している可能性が示唆されている。
帝王切開で出産した女性の母乳には、経膣分娩で出産した女性よりも低い微生物叢の多様性が観察される。
妊娠期間もヒトの母乳の微生物組成に影響を与え、これは早産児の母乳におけるビフィズス菌の存在量が経産児の母乳よりもはるかに少ないことからも明らか。
母乳育児の様式については、直接母乳育児および手動式表現と比較して、間接的母乳育児およびポンプ式は母乳微生物相の多様性および豊かさの低下、潜在的病原体のコロニー形成率の上昇、およびビフィズス菌の存在量の低下と関連している。
・粉ミルクの種類
粉ミルクには、牛乳、大豆、低アレルギー性、無乳糖などがある。
中で最も多く飲まれているのが牛乳で、約3.4%のたんぱく質が含まれており母乳よりもかなり高い。乳糖やラクトフェリンの含有量は母乳よりも少ない。
ヒト母乳中に存在する13種類のオリゴ糖がウシ初乳中に同定されており、ウシ乳はヒト乳と同等の生理活性を有するオリゴ糖の供給源となり得ることが示唆されている。
しかし、ウシ乳中のオリゴ糖の濃度や多様性はヒトミルクに比べ低いことから、乳児用粉ミルクメーカーは、ヒトのミルクに近い栄養プロファイルを再現するために、ウシのミルクを修正したり再調合したりしている。
牛乳タンパクアレルギーは、小児に最も多く見られる食物アレルギーのひとつ。
牛乳の代わりに使用できる粉ミルクとして、大豆を主成分とする粉ミルク、加水分解物を主成分とする粉ミルク、アミノ酸を主成分とする粉ミルクがある。
加水分解粉ミルクは一般に牛乳の代用として使用され、アミノ酸系粉ミルクは非アレルギー性であることから加水分解粉ミルクの代替となりえる。
大豆ベースミルクは、生後6ヶ月以上の乳児で加水分解ミルクに耐えられない場合、両親が他の特殊なミルクを買えない場合、または両親が菜食主義のため強く希望する場合にのみ考慮されるべき。
大豆粉ミルクに高濃度のイソフラボンが含まれていることから、乳児の発達にエストロゲンが影響を与える可能性が懸念されている。
・粉ミルクへのプレバイオティクスとプロバイオティクスの添加
母乳栄養児と同等の腸内細菌叢の形成を促進するため、メーカーは粉ミルクにプレバイオティクスとプロバイオティクスを添加することが多く、これらはビフィズス菌作用を持ち、免疫系を調節する。
プレバイオティクス・オリゴ糖を育児用ミルクに添加すると、健康な乳児の耐容性が高く、添加しない場合と比較して便が柔らかくなることが研究で証明されている。
乳児用ミルクに2種類の一般的なHMO-2′フコシラクトースとラクト-N-ネオテトラオースを添加した研究では、添加ミルクは乳児の適切な成長をサポートできることが報告された。
またこれら2つのプレバイオティクスオリゴ糖を粉ミルクに添加すると、ビフィズス菌の増殖が促進され、母乳栄養児に近い腸内細菌組成になることが報告された。
ウシミルク由来のオリゴ糖を含む乳児用ミルクがビフィズス菌増殖効果を示し、乳児の腸内細菌叢を調節し、腸の成熟を促進することが明らかになっている。
プレバイオティクス(牛乳由来オリゴ糖)とプロバイオティクス(Bifidobacterium animalis sp. lactis)の両方を添加した粉ミルクを与えられた乳児は、添加していないミルクを与えられた乳児と比較してビフィズス菌と乳酸菌のレベルが高く、糞便pHが低く、糞便分泌IgAが高くなることを示した研究もある。
欧州小児消化器栄養学会(ESPGHAN)の栄養委員会とESPGHANプロバイオティクス・プレバイオティクス作業部会は、L. rhamnosus GG(LGG)ATCC53103(1×109CFU~6×109 CFU / day)および B. infantis Bb-02、B. coliの組み合わせの使用を推奨している。
また、B.infantis Bb-02, B. lactis Bb-12, Str. thermophilus TH-4 (各株3.0~3.5 ×108CFU /day) の組み合わせで、早産児の壊死性腸炎 (NEC) ステージ2または3を抑制することが示された。
・母乳栄養児と粉ミルク栄養児の腸内細菌組成の違い
母乳をもらっている乳児の腸内細菌は粉ミルクをもらっている乳児の腸内細菌と異なっている。
健康な微生物叢に不可欠なビフィズス菌は、母乳栄養児の方が粉ミルク栄養児よりも多いことが研究で報告されている。
母乳栄養児と粉ミルク栄養児では、HMOs発酵の主要代謝物である糞便中SCFAsのレベルが異なり、母乳栄養児の方が高レベルであることがわかっている。
*幼少期の腸内細菌が健康や疾病に与える影響
・壊死性腸炎(Necrotising Enterocolitis)
壊死性腸炎(NEC)は未熟児が罹患する消化管の重篤な炎症性疾患で、妊娠年齢が早ければ早いほどNECによる死亡率は高くなる。
早産児の腸内細菌叢の異常および成熟の遅れはNECの高リスクと関連する。
未熟児は、腸内細菌叢の変化と関連する独立した因子であり、さらに早産児は抗生物質による治療や長期の入院治療を受けることが多く、腸内細菌叢に直接影響を及ぼす可能性がある。
NICUに入院中の安定期/健康期の早産児29人の便サンプルを調査した研究では、Proteobacteriaが最も豊富な門だった。
他の研究でも同様の細菌門が観察されており、満期経膣分娩母乳栄養児(FTVDBF)とVLBW早産児の糞便試料を比較したところ、早産児ではFirmicutesとProteobacteriaの濃度が高く、BacteroidetesとActinobacteriaの濃度がFTVDBF児と比較して低下していることがわかった。
また、糞便中のSCFAs濃度も早産児では低く、早産児の腸内細菌叢には組成以外にも機能的な変化があることが示唆された。
腸内細菌の多様性の低下、特定のクラスの細菌、例えばClostridiaの不在または有意に低い存在比が、NECのリスクおよび重症度の上昇と関連すると報告した研究もある。
これらは、多様な微生物叢と特定の細菌群がNECにつながる炎症反応を抑制する可能性を示唆している。
ヒトミルク(母乳またはドナー)は、早産児用ミルクと比較してNECの発生率が低下することから、ヒトミルクはNECから保護すると考えられる。
母乳のみを1週間以上摂取した未熟児に比べ、母乳のみを1週間未満摂取した未熟児ではNECの発生率が高いことから、壊死性腸炎の発症リスクを低減するためにはより長期間のヒトミルクを排泄することが推奨されている。
ヒトミルクのみを与えられた早産児は、早産児用ミルクを与えられた早産児と比較して糞便中の総SCFAs濃度が有意に高く、ヒトミルクを与えられた乳児のSCFAs濃度の上昇は、NECのリスク低減と関連していることが示唆されている。
プロバイオティクスは超低出生体重早産児の壊死性腸炎の予防に使用されているが、その効果についての研究結果は一致していない。
欧州小児胃腸栄養学会(ESPGHAN)栄養委員会およびプロバイオティクス・プレバイオティクス作業部会は、調査したプロバイオティクス菌株または菌株の組み合わせのうち、病的状態および死亡率の減少に有効であると認められたのはごく少数であると報告している。
エビデンスの確実性は低いものの、壊死性腸炎のリスクを下げるために、Lactobacillus rhamnosus GG ATCC53103 またはBifidobacterium infantis Bb-02, Bifidobacterium lactis Bb-12, Streptococcus thermophilus TH-4の組み合わせの使用がESPGHANによって条件付きで推奨されている。
・肥満
乳幼児や小児肥満の増加が世界的に懸念されている。
体重過多や肥満の子どもは、肥満成人になりやすく慢性疾患を発症しやすい。
乳幼児の腸内細菌叢が小児期の過度の体重増加のリスクを予測因子であることが近年分かっている。
ある大規模研究では、乳児期の腸内細菌組成、特にBacteroides fragilisの豊富さが小児の体重増加と有意に相関していることが報告されている。
また、乳児期のレンサ球菌濃度は小児期の肥満度(BMI)と正の相関があるのに対し、ビフィドバクテリウムの濃度はBMIと負の相関があることが分かっている。
分娩形態や周産期における抗生物質への曝露など、乳児期の腸内細菌叢の発達に影響を及ぼす因子は小児期の脂肪率と関連することが分かっている。
帝王切開と生後6ヶ月間の抗生物質の使用は、後年の体高と関連している。
抗生物質への曝露よりも、むしろ乳児期に未治療の感染症(腸内細菌を破壊することもある)が小児期の過度の体重増加に相関していることを示唆した研究もある。
いくつかの研究では、少なくとも6カ月間母乳で育てられた子どもは母乳をもらったことがない子どもと比較して、小児期の体重過多や肥満リスクが低いことが報告されている。
乳児期の母乳育児の期間と子どもの過体重または肥満のリスクとの間に用量反応関係があることを明らかにした研究もある。
粉ミルクを対象とした研究では、タンパク質含有量の多い粉ミルクを与えられた乳児に比べ、タンパク質含有量の少ない粉ミルクを与えられた乳児はBMIが低く、高年齢での肥満リスクも低いことが明らかになった。
乳幼児期の高タンパク質摂取はより急速な体重増加と関連しており、その結果、より高い脂肪率をもたらすと考えられている。
牛乳の粉ミルクを与えられた乳児は、加水分解粉ミルクを与えられた乳児と比較してより有意な割合で体重増加が速かった。
乳児期の急速な体重増加と後年の高いBMIとの間には関連性がある。
・アトピー
アトピー性疾患の発症は幼少期の腸内細菌叢に影響されている可能性がある。
乳幼児期における腸内細菌の多様性の低下が、アトピー性疾患の発症リスクの上昇と関連することが研究により明らかにされている。
生後5週〜13週の乳児におけるClostridiaのコロニー形成が、アトピー性皮膚炎の高い発症リスクと関連することが示されている。
IgE関連アトピー性皮膚炎の乳児は、過剰なTLR2反応と関連するRuminococcaceaeが少なく、乳児の腸内細菌組成が免疫シグナル調節を介して湿疹感作と相関している可能性を示唆した研究もある。
また、生後3週間で腸内細菌科に濃縮されることでバクテロイデス科のコロニー形成が遅れ、アトピー性皮膚炎児の腸内細菌科/バクテロイデス科比率が上昇することが明らかになった。
さらに、喘息リスクのある小児において、生後数ヶ月の間に腸内細菌叢の一過性の異常があることを明らかになっている。
これらの小児は、生後3カ月で腸内細菌叢におけるLachnospira、Veillonella、Rothia、Faecalibacteriumの存在比が低下していた。
ヒトの母乳がアトピー性疾患の発症を予防することが研究により明らかになっている。
Canadian Healthy Infant Longitudinal Developmentの出生コホートの3296人の子どもを対象とした研究では、生後3カ月間の母乳育児に比べ、粉ミルク育児と混合育児は3歳までに喘息になるリスクが高いと報告されている。
帝王切開で出産した乳児では小児喘息の発症リスクが高かったが、生後6カ月間の母乳育児はこのリスクを低減させる可能性がある。
母乳育児の期間が短い子供と母乳育児でない子供で、アトピー性皮膚炎の発症リスクがわずかに上昇することを明らかにした研究もある。
米国小児科学会の最近の臨床報告では、生後3~4カ月母乳のみで育てられた乳児は、2歳までアトピー性皮膚炎のリスクが減少すると結論づけている。
さらに、母乳育児をより長く続けることで5歳を超えても喘息に対する保護作用が得られるとした。
アトピー性疾患の予防におけるプレバイオティクス補給の効果に関するエビデンスは一貫していない。
乳児のアレルギー予防のためのプロバイオティクス補給の使用は議論の余地がある。
妊娠期間最後の2カ月間とその後の授乳中の2カ月間に、母親にLactobacillus rhamnosus LPR + Bifidobacterium longum BL999 またはLactobacillus paracasei ST11 + Bifidobacterium longum BL999を補充した場合の効果を評価した研究では、乳児が生後2年間にアトピー性皮膚炎を発症するリスクが有意に低下したことが報告された。
また、Lactobacillus rhamnosus HN001を産後35週から6カ月までの母乳育児の母親と生後2年間の乳児に投与すると、アトピー性皮膚炎から乳児を保護することを示した研究もある。
一方で、早期のプロバイオティクス補給はアトピー性疾患を予防しないことを報告した研究もある。
つまり、プレバイオティクスやプロバイオティクスの摂取がアトピー性疾患の予防につながるかどうかは、研究間の異質性、特に使用したプレバイオティクスやプロバイオティクスの種類や摂取期間に関する異質性依存的でまだ不明。