今回のブログは、肺がん治療における栄養学的アプローチに関する研究をまとめてみたい。
肺がんだけでなく他の多くのがん治療においても参考になると思う。
栄養マネジメントは、がん治療(手術、化学療法、放射線療法)から治療終了後の回復、二次予防、緩和ケアまで、がん治療のすべての段階で重要な役割を果たす。
リンクのレビューのは、食事と肺がん治療の効果の関するのエビデンスを要約したもの。
1977年から2022年6月までに発表された論文を含むEMBASEおよびPubMedデータベースで文献検索。
抗酸化物質であるビタミンA、アスコルビン酸(ビタミンC)、ビタミンE、セレン、亜鉛が、身体の抗酸化バリアを強化することが示され、術前の免疫栄養は肺がん手術患者の化学放射線療法後の栄養状態を改善するだけでなく、術後合併症の重症度を軽減する可能性がある。
タンパク質供給は、平均体重と筋肉量の増加により人間の健康に有益な効果を発揮する可能性が示された。
食事中オメガ3脂肪酸の含有量とその主な供給源である魚の消費は、化学療法や放射線療法を受けた肺がん患者の炎症に対して調節効果をもたらす可能性がある。
さらに、n-3系脂肪酸は腫瘍細胞の増殖を抑制し、化学療法の毒性を軽減する可能性がみられた。
エネルギーとタンパク質摂取量の増加は、肺がん患者のQOL、機能的転帰、手の握力、症状、パフォーマンスの改善と強く関連していた。
栄養療法は、肺がん患者の治療において薬物療法と並ぶ標準的な治療法であるべきと結論。
Diet as a Factor Supporting Lung Cancer Treatment—A Systematic Review
がん治療における栄養素の役割
脂質はタンパク質や核酸と同様に細胞の構成要素であり、細胞内外のシグナル伝達分子。
エイコサペンタエン酸(EPA)は特定の臨床効果を持つ脂肪酸として認識されており、EPAの潜在的利点を説明するメカニズムとして炎症性サイトカイン産生調節による異化刺激の抑制、インスリン感受性の向上、タンパク質合成が誘導されることが提案されている。
また、EPAは炎症を抑え、栄養状態/体組成を変調させる可能性があることが示されている。
いくつかの研究では、n-3系脂肪酸はがん細胞増殖を抑制し、化学療法の毒性を軽減する可能性があることが示されている。
多くの研究で筋肉量に対するn-3系脂肪酸のポジティブな影響が報告されていることから、n-3系脂肪酸の介入は大きな副作用なしに筋肉の減少を防ぐのに役立つ効果的な解決策となり得る。
ω-3多価不飽和脂肪酸(PUFA)は化学療法や放射線療法を受けた肺がん患者においてC反応性タンパク質(CRP)とTNFαレベルを有意に低下させることがわかっており、炎症に対して何らかの調節効果を持つ可能性を示唆している。
悪性腫瘍を患う患者は、異化作用と安静時エネルギー消費量の増加を示す。
オメガ3系PUFAは筋繊維の細胞膜や細胞内小器官と結合して筋タンパク質の損失を防ぎ、その合成をアップレギュレートする可能性がある。
オメガ3系PUFAは、がん患者の栄養療法によく使われる「免疫栄養素」とされ、細胞膜流動性や構造、細胞シグナル伝達において重要な役割を果たし、抗炎症作用も示す。
放射線療法や化学療法を受ける肺がん患者では栄養不良がよく見られる。
酸化ストレスは放射線療法や化学療法による細胞毒性作用や、いくつかの有害事象において重要な役割を担っている。
ステージIIIB-IVのNSCLC(非小細胞肺がん)患者66名を、システインに富むタンパク質を摂取するグループとカゼインを摂取するグループに分けた結果、システイン豊富なタンパク質を摂取した患者は、平均2.5%の体重増加が見られたのに対し、カゼインを摂取した患者は2.6%の体重減少が見られた。システインに富むタンパク質補給を受けた肺がん患者は生存期間が長く、握力が強く、QoLが良好だった。
がん患者の食事では、血糖値を急上昇させる消化の早い炭水化物を少なくする必要がある。
がん化学療法の副作用として、活性酸素の産生が増加することで有害事象が発生して治療が中止されることが多い。ビタミンA、C、E、セレン、亜鉛は抗酸化物質であり、体内の抗酸化バリアを強化する可能性がある。
ビタミンCは肺がん細胞株の増殖を抑制し、細胞周期停止とアポトーシスを誘発する。
ある試験では、ビタミンC補充を行った化学療法を6週間行った後、NSCLC患者においてビタミンA、C、Eの血漿中濃度が有意に上昇することが示された。
最も増加したのはビタミンC(99.8%)で、進行したNSCLCを患う患者の予後に好影響を与える可能性がある。
乳がん、卵巣がん、肺がん患者を対象とした試験では、化学療法による末梢神経障害の感覚・運動症状や痛みに対するビタミンB12、E、アセチル-L-カルニチン、グルタミンの影響を調査した研究では、ビタミンEを1日400mg投与した群ではすべての症状が軽減され、その効果はB12も同様だった。ビタミンEはアセチル-L-カルニチンとグルタミンの両方と比較して、感覚・運動症状および痛みの大きな減少をもたらした。
高用量ビタミンAの毎日の経口投与は、タバコに関連した原発腫瘍の数を効果的に減らし、ステージIの肺がんの治癒切除を受けた患者の無病期間を延長する可能性が示されている。
セレンと亜鉛は、酸化ストレスの軽減と活性酸素からのDNA保護に大きな役割を果たす。
亜鉛は腫瘍発生と進行に対して保護的である可能性があり、いくつかのタンパク質の必須補因子でもある。これらの要素はいずれもDNA修復システムを効果的にサポートし、腫瘍の成長を抑制する可能性がある。
電解質バランスの乱れはがん患者で非常に多く、治療成績の低下、QoL、投薬の選択肢、生存率に影響を与える可能性がある。
したがって、ナトリウム、カリウム、カルシウム、マグネシウムといった電解質レベルの迅速な補正は、プラスの効果をもたらす可能性がある。
肺がん治療を支える食事要因
肺がんは下葉よりも上葉に多く発生するが、その病態生理的背景はまだ解明されていない。
ある分析では、上葉の独立した予測因子として家族の肺がん歴、アスベスト曝露歴、黄色-オレンジ野菜の摂取量が少ないこと、ビタミンE摂取量が少ないことが示された。
上葉腫瘍の位置とビタミンEおよび黄橙色野菜の摂取量との間に強い逆相関があることが示された。
3108人のヨーロッパ人男性を対象に、果物や野菜摂取量と肺がん死亡率の関連を調査した研究では、そのうちベースライン時に喫煙していたのは1578人で、25年間の観察で喫煙者のうち149人が肺がんで死亡した。喫煙者において、果物の摂取量と肺がん死亡率の間に逆相関があることがわかった。
フィンランドでは果物摂取量が多いほど肺がんのリスクが低下したが、有意ではなかった。
イタリアでは関連性は認められなかった。
喫煙者の参加者では野菜消費量は肺がんリスクと関連しなかったが、喫煙強度で層別化した場合、野菜を多く摂取している人は肺がんリスクが低いことを示唆する分析結果が得られた。
全体として、ヨーロッパの男性喫煙者では果物摂取と肺がん死亡率の間に逆相関が示された。
7カ国調査の集計データを用いて喫煙と食事が肺がん死亡率に与える影響を検討した研究では、25年肺がん死亡率と喫煙率および集団の平均食事摂取量との間に相関があった。
喫煙者の肺がん死亡率と脂肪、特に飽和脂肪の平均摂取量との間に正の関係があった。
L高エネルギー・高タンパク質食の宅配食サービスがQoLに及ぼす影響を肺がんの栄養不良患者40名を対象に調査した研究では、高エネルギー・高タンパク質食と間食を週3回配達してもらう介入群(IG)と通常の食事を続ける対照群(CG)に無作為に分けられ、IGはCGと比較して6週間後および12週間後の椅子立ち上がりテストに改善がみられた。
12週間後はパフォーマンスに有意なプラスの影響があった。
肺がん患者においてエネルギーとタンパク質摂取量の増加とQoL、握力の向上、スコア、症状、機能、パフォーマンスの結果との間に強い関係があることが明らかになった。
16,693人を対象とした研究では、非喫煙者における25(OH)D血清濃度と肺がん死亡率の間に関連があることがわかっている。
注意が必要なのは、循環中ビタミンA濃度が過剰な者や、ビタミンAやベータカロチンのサプリメントを摂取している参加者では25(OH)Dの利益は小さかったことである。
シカゴ大学病院で治療を受けた35人の肺がん患者から採取した63個の腫瘍サンプルにおいて、核および細胞質ビタミンD受容体(VDR)が多数のサンプルで発現していた。
カルシトリオールは肺がん予防剤として機能する可能性を示唆している。
シスプラチンとパクリタキセルを投与されたNSCLC患者において、栄養不良と血清アルブミン濃度、化学療法による毒性との関連について調査した研究では、パクリタキセル(175mg/m2)とシスプラチン(60mg/m2)を投与されたステージIVのNSCLC患者100人のうち50%の患者がアルブミン濃度が3.0mg/mL以下だった。
好中球リンパ球比≧5、ECOG=2、血小板リンパ球比≧150は、ベースラインの体格指数(BMI)≦20および低アルブミン血症と有意な関連があった。
栄養不良および低アルブミン血症の患者では、栄養状態が正常でアルブミン値が正常な患者よりも化学療法による毒性が全体的に大きくなった。
アルブミン値が正常な場合と比較すると、低アルブミン血症と疲労、貧血、食欲不振の間に関連があった。
血小板リンパ球比150以上は貧血およびグレードIII/IVの毒性に関連し、全身性炎症反応パラメータと毒性は低アルブミン血症および栄養失調と関連があった。
ランダム化比較試験において、多剤併用療法(化学放射線療法後に手術)を受けているNSCLC患者にn-3多価不飽和脂肪酸(PUFA)を含むサプリを投与し、QoL、握力、パフォーマンスステータス、身体活動を評価した研究では、多剤併用療法を受けているステージIIIのNSCLC患者40名を、n-3PUFAを含むタンパク質とエネルギーが豊富なサプリを摂取するグループと等カロリーの対照食品を摂取するグループに分けた。
5週間後、QoL、グローバルな健康状態、身体的・認知的機能、社会的機能はサプリ群で対照群より有意に高くなった。
また、サプリ群は3週間後に対照群と比較してカルノフスキー・パフォーマンス・ステータスが高くなった。また、3週間後と5週間後に対照群と比べて高い身体活動量を示した。
n-3PUFAは多剤併用療法を受けているNSCLC患者のQoL、パフォーマンスステータス、身体活動に良い影響を与える可能性がある。
肺がん患者へのEPAとDHA(ドコサヘキサエン酸)の投与が抗炎症作用と抗酸化作用を持つことを実証した研究もある。
この多施設共同無作為化二重盲検試験では、手術不能の進行性NSCLCと診断され、化学療法を受けた患者33名を2群に分け、EPA510mg+DHA340mgを配合したカプセルを1日4カプセル(IG)、グループ2にはプラセボ850mg(CG)を66日間投与。
化学療法開始時、8日後、22日後、66日後に両群で生化学的(炎症性、酸化性)および人体計測パラメータを記録。
66日間の化学療法後、IGでは体重の有意な増加が認められた。
炎症に関しては66日後のCRPとIL-6濃度に群間で有意差があり、IGでは化学療法の経過とともに徐々に減少し、PUFAの抗炎症作用が示された。
治療期間の後半になると、血漿中活性酸素量がIGに比べてCGで増加した。
HNE濃度はCGで増加し、IGでは安定した状態を維持した。
ある臨床試験では、魚油の投与により化学療法中の筋肉量と体重が維持されることが実証された。対象はNSCLC患者46名。化学療法の開始から終了まで16人の患者に魚油(1日2.2gのEPA)を投与し24人を標準治療(SOC)に割り当て。
SOC群では平均2.3±0.9kgの体重減少が見られたのに対し、魚油投与群は体重を維持した。
最大筋肉量の増加は、魚油の補給後に血漿中のEPA濃度が最も上昇した患者で観察された。
筋肉量増加または維持は、介入グループの患者の約69%で記録された。
一方、SOC群では1kgの筋肉量減少が観察され、筋肉量を維持したのは同群の患者の29%にとどまった。
総脂肪組織については、両群に差はなかった。
別の研究では、魚油(EPA+DHA)が、肺がん患者の化学療法による臨床効果や毒性、生存率に与える影響が評価された。
合計31人の患者がSOC群に、15人の患者が魚油群に割り当てられた。
奏効率、臨床的有用性、1年生存率は、魚油群がSOC群より高かった。
ダブルルーメンチューブの発生率には両群間に差はなかった。
SOCと比較して、魚油補給は化学療法の毒性プロファイルに影響を与えることなく、その効果を高めることがわかった。
したがって、肺がん患者の生存期間を延長するのに役立つと考えられる。
2014年1月から12月にかけて肺切除術を受けた58名の患者群を対象にたRCTでは計31人の患者が術前栄養プログラム(IG)に組み込まれ、10日間免疫調節フォーミュラ(n-3脂肪酸、アルギニン、ヌクレオチドを含む)を摂取した。
対照群は27名の患者で、通常の食事が提供された。
手術3日後、CGではアルブミン値が基準値の25.71%まで減少したことが確認された。
一方、IGでは14.69%の減少にとどまった。
合併症はCGでは12人、IGでは6人だった。
胸腔チューブによるドレナージ期間の平均は、CGで6日、IGで4日だった。
以上のことから、解剖学的切除を受けるNSCLC患者における術前栄養は合併症発生率と胸腔ドレナージ期間の短縮という点で有益な効果を持つことが示された。
結論
栄養戦略はがんと闘う体をサポートし、肺がん治療における重要な側面と考えられる。
上にまとめたレビューは、必須栄養素と抗酸化物質の補充が肺がん治療に有益な効果をもたらす可能性があることを実証している。
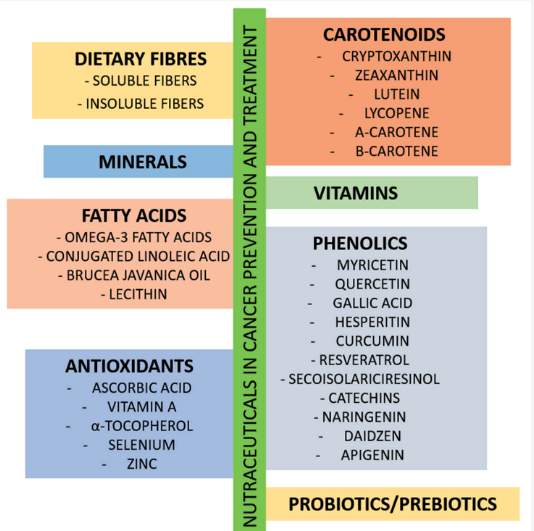
栄養戦略の主な目的は、栄養失調とがんに関連した悪液質を防ぐこと。
診断時点から適切な栄養を摂取することで周術期合併症リスクを低減し、化学療法、放射線療法、免疫療法の副作用を最小限に抑え、免疫系を強化することができる。
上にまとめた論文から提供された情報により、疾患が診断と同時に栄養状態を評価し、起こりうる合併症を回避するために食事介入を行うべきで、その結果QoLが向上し、生存率の向上に関連することが証明された。