本日のブログは茶ポリフェノール(TP)と腸内細菌叢および中枢神経系のトライアドについて書かれた興味深い記事をまとめていきたい。
中枢神経系疾患や腸関連疾患の治療におけるTP療法の概要について述べている。
Mechanisms Underlying the Interaction Between Chronic Neurological Disorders and Microbial Metabolites via Tea Polyphenols Therapeutics
・茶ポリフェノールと生化学的性質
茶ポリフェノール(TP)は、茶に含まれるフェノール化合物の総称で、強い抗酸化作用があることが実証されている。
TPは水酸基を通じて活性水素を供給し、より安定なフェノールフリーラジカルを生成して、活性酸素やフリーラジカルを消去する。
さらに、幅広いスペクトラムと強い抗菌能力を示し、自然界の何百もの細菌に一定の抑制効果を発揮する。
TPは鉄、カルシウムなどの金属イオンと反応して環状キレートを形成することから、補酵素として多くの金属イオンが存在する細菌の酵素、活性、成長と繁殖に影響を与える。
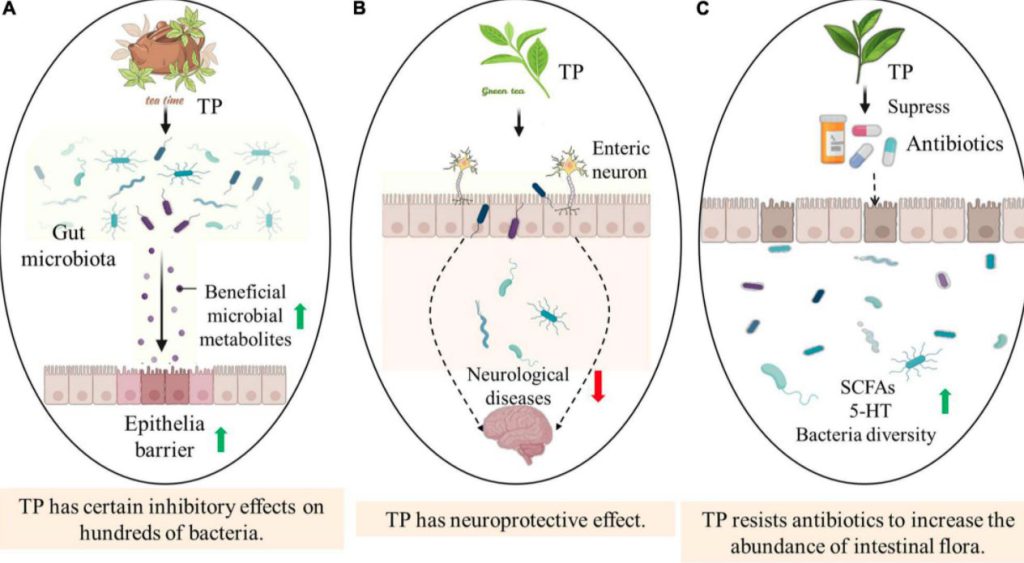
TPは抗酸化作用、フリーラジカルの消去、金属イオンのキレート作用、抗がん作用、抗炎症作用、抗アポトーシス作用、神経変性疾患の予防など、疾患治療の可能性も秘めている。
過去の多くの研究では、TPはパーキンソン病(PD)の動物モデルにおいて脳の損傷に対する保護効果を有することが報告されている。TPとエピガロカテキンガレート(EGCG)は、線条体のドーパミン消費量と黒質ドーパミン作動性ニューロンのアポトーシスを減少させる。
豊富な動物モデルにおいてEGCGなどのTPが血液脳関門を通過することが報告されている。
ラットにEGCG(500mg・kg)を摂取させたところ、脳内EGCG濃度は0.5 nmol・gに達し、脳組織に局在することがわかった。
これらの結果は、TPが神経保護作用や神経調節作用を持つ生理活性物質を潜在的に持っていることを示唆している
TPの抗酸化作用は、フリーラジカル、神経細胞アポトーシスからドーパミン系を保護すると考えられる。
TPが中枢神経系(CNS)で脂質の酸化と二価鉄の錯体の蓄積を抑制することが、神経保護効果の主なメカニズムであると考えられる。
TPの脂質過酸化抑制効果には、フリーラジカルの消去が含まれる。
TPは酸素イオンなどの活性酸素を効果的に消去し、脂質過酸化の開始を防ぐ。次に、過酸化脂質フリーラジカルと反応して鎖の切断を引き起こす。
TPは2つの作用の組み合わせで、大きな抗脂質酸化機能を示すようになった。
TPはミトコンドリアにおいて、体重増加を減らす程度のエネルギー消費量を刺激する可能性がある。
同時に、脂肪酸合成酵素遺伝子発現を抑制することで血中脂質と細胞の成長を抑制する可能性がある。
一方、EGCGは重要な抗酸化物質で鉄キレート物質でもある。
EGCGはキレート金属イオンを介したDNA損傷を90%以上抑制する。
TPの保護効果は、フリーラジカル消去または金属キレート作用に一部起因している。
・腸内細菌叢の重要な役割
ヒト腸内細菌は種類と数によって、バクテロイデス属、プレボテラ属、ルミノコッカス属の3つに分けられる。
バクテロイデス系は主に炭水化物とタンパク質からエネルギーを得ており、プレボテラ属は腸内の糖タンパク質の消化に作用する。
腸内細菌叢の種類と数は、人によって異なる消化能力、免疫能力、薬物に対する反応などを反映しており、研究者はそれらの情報も病気の診断や治療の参考となると考えている。
乳酸菌ラクトバチルス・プランタルムは、宿主の健康に貢献するプロバイオティクスとして使用でき、メタボリックシンドローム、糖尿病、脳疾患に対して有益な効果を発揮することが確認されている。
また過去の研究で、ラクトバチルス・プランタルムZLP001が、腸管上皮を強化し、腸内細菌叢組成を調節して腸管バリア機能を強化できることが報告されている。
さらに、糖尿病になりやすいラットにラクトバチルス・ジョンソニーN6.2および/またはロスマリン酸を摂取させた研究では、一定期間後、ラットの初期胃腸炎が有意に緩和されたことが確認されている。
プロバイオティクスとして、ラクトバチルス・ジョンソニーN6.2は、インターロイキン(IL)-1βなどの炎症性サイトカインのレベルを下げ、インターフェロン(IFN)-γの転写レベルを下げることができる可能性がある。
一方、慢性疾患の進行は腸内細菌叢の乱れ(ディスバイオーシス)を悪化させるという研究結果がある。
腸内細菌は主にファーミキューテスとバクテロイデスで構成されており、腸内のF/B比率は糖質代謝に影響を与えるだけでなく、短鎖脂肪酸(SCFA)の産生を変化させる。
健常者の腸管上皮間には、腸管上皮細胞同士をつなぐ強いタイトジャンクションタンパク質が存在する。
しかし、糖尿病患者の高血糖は腸管バリアの損傷を誘発し、細菌代謝物が体内に入り込み、病原性細菌の増殖、移行を促進し、腸管感染状態を悪化させることにつながる。
ディスバイオーシスには腸内真菌やウイルスの変換も含まれる。
抗真菌治療や一部の希少真菌の接種による腸内真菌症は、過剰な免疫反応を引き起こすことが2018年の研究で示され、免疫恒常性における腸内真菌の重要な役割が明らかになりつつある。
その前年(2017)には、クローン病の独特な腸内環境が真菌の作用機序となる一方、細菌の成長と繁殖を損ね、腸内細菌叢の摂動を促進する可能性が示唆されている。
・腸内細菌叢由来代謝産物と宿主の健康への影響
代謝は、宿主、宿主微生物叢、侵入する病原体に関わるすべての細胞プロセスに共通している。
腸内細菌叢が宿主と相互作用する方法の1つは、微生物代謝の中間産物または最終産物である代謝産物の媒介がある。
代謝産物は、食物の消化、胆汁酸などの宿主分子の修飾、あるいは細菌から直接得られる。
これらの代謝シグナルは免疫恒常性、宿主のエネルギー代謝、粘膜の完全性などに影響を与える。
また、このような小さな生物が大きな影響を与える理由の一つは、代謝産物を血液循環に分泌することが挙げられる。
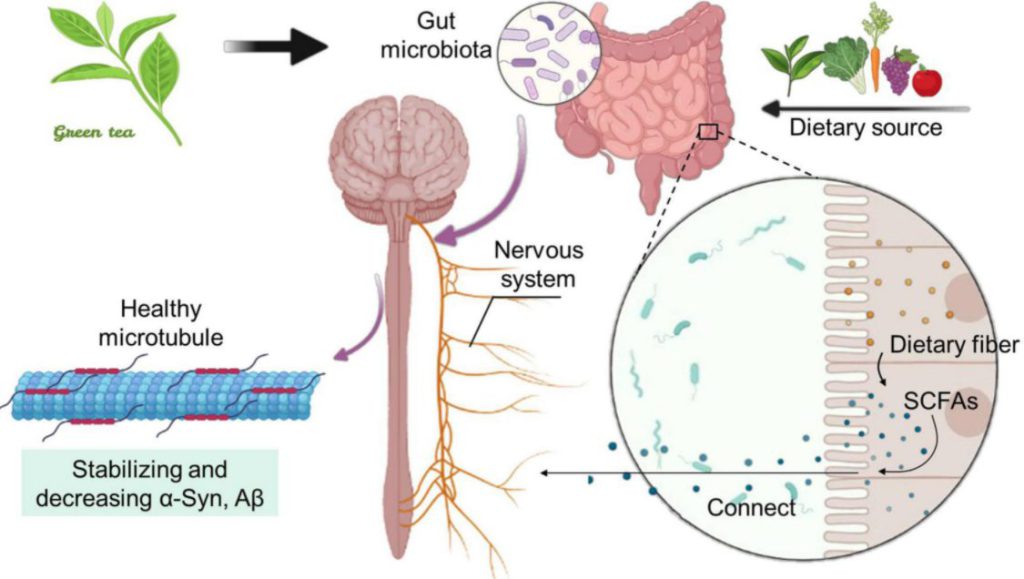
腸内細菌とその代謝産物は、腸管透過性、粘膜免疫機能、消化管運動、腸管神経系(ENS)活性に影響を与え、消化管機能を調節している。腸内細菌とその代謝産物は、ストレス反応、情動行動、疼痛調節、摂食行動、脳生化学などの行動や脳プロセスの調節にも関与していると考えられている。
SCFAは主に酢酸、プロピオン酸、酪酸、吉草酸を含み、腸管内腔に存在する微生物量が多い代謝物の一つ。
プロバイオティクス、ラクトバチルス・ジョンソニーN6.2とフェノール類の使用は、高脂肪食によるメタボリックシンドローム関連疾患の改善、腸管の健康維持と安定化に役立ち、SCFAの代謝産生を促進する有効な方法であることが研究で明らかにされている。
SCFAは、炎症の抑制、自己免疫疾患やアレルギーの改善、腸管バリアの維持、腸内病原菌のコロニー形成抵抗性の仲介など、宿主の健康を高め、腸、神経、内分泌、血液系など複数のシステムの機能を調節する。
また、SCFAは、腸内細菌間の最も重要な必須媒体として、生体の複数の臓器・組織で直接的・間接的に重要な生理的役割を担っている。
食物繊維が細菌叢の作用で産生するSCFAは、腸管だけでなく、脳の遠位部にも作用することが多くの研究で明らかにされている。
Gpr41はSCFAs受容体の一つとして、交感神経節、迷走神経、後根神経節、三叉神経節などENS以外にも末梢神経系に広く発現している。
SCFAsの脳への作用として、静脈内投与時に少量の酢酸が血液脳関門を通過して吸収され、視床下部ニューロンを活性化し、満腹感をもたらすことが知られている。
トリプトファンは生体に重要なアミノ酸で、腸内細菌叢などの経路によって産生される代謝産物を通じて、宿主の代謝に影響を及ぼす。
トリプトファンは腸内細菌叢によってインドールおよびアリール炭化水素受容体リガンドと呼ばれる誘導体に分解される。また、免疫細胞および上皮細胞ではキヌレニン経路によって代謝され、その活性は腸内細菌叢によって調節される。
また、腸クロム親水性酵素1によって5-HTが生産される。
ヒトの細胞はトリプトファンを産生できないため、ヒトは外来性、主にバナナ、牛乳、ピーナッツなどの食事からの摂取に頼っている。
トリプトファンは代謝経路で脱炭酸を達成して神経伝達物質トリプタミンを産生する。
トリプタミン(クロストリジウム・スポロゲネスやRuminococcus gnavusが産生するトリプトファン代謝物)は、β-アリールアミン系の神経伝達物質で腸の健康に関与している。
腸内では、トリプタミンは神経伝達物質5-HTの放出を誘導し、5-HTは腸管神経系のニューロンを介して消化管運動を刺激する。
5-HTは、大脳皮質や神経シナプスに多く含まれる抑制性の神経伝達物質で、記憶力を高めたり、神経細胞を「興奮性神経毒」のダメージから守る働きがあり、一般に幸福感に寄与すると考えられている。
・ディスバイオーシスが身体に与える影響
ディスバイオーシスは、炎症性腸疾患(IBD)などの様々な消化器疾患の引き金となったり、悪化させたりする。
腸内細菌叢で嫌気性菌が減少し、通性嫌気性菌が増加すると腸の炎症が増加する。
IBD患者では、クロストリジウム属などのSCFA産生微生物の数が減少していることが観察されている。
細菌由来のSCFA、特に酪酸は、制御性T細胞や腸管粘液の産生を促進し、炎症シグナル伝達経路を遮断して上皮のバリア機能を強化する。
IBDマイクロバイオームのもう一つの特徴として、トリプトファン代謝の低下が挙げられる。
ペプトストレプトコッカス属の数種類が産生するトリプトファン代謝物インドールアクリル酸は、粘膜バリア機能を促進し、炎症を抑制する。
腸内細菌叢の不健康な状態の発生に関与する要因として、食事パターンの大幅な変化、微生物感染症、薬剤(特に抗生物質)の頻繁な使用などが挙げられる。
外的擾乱により安定した微生物生態系が不安定な状態に追い込まれることがある一方、外的擾乱によってより健康的で安定した別の状態になることもある。
安定した細菌叢は外来細菌や病原体の侵入や拡大に抵抗し、その結果、コロニー形成抵抗と呼ばれる現象が生じる。
・茶ポリフェノール(TP)の腸内細菌叢への有益な効果
腸内細菌叢組成と機能に対するTPの調節は一般に用量依存的で、TPの用量次第では抗生物質作用後の乳酸菌の相対的存在量を劇的に変化させることができる。
低用量TP(1日量90mg/kg)は抗生物質による乳酸菌の存在量の減少に拮抗し、通常群(蒸留水のみ投与)よりも有意に高値であった。
高用量のTP(1日360mg/kg)は、プロバイオティクスに悪影響を及ぼし、乳酸菌の不活性化につながる可能性がある。
またTPの過剰摂取は、動物の肝臓への損傷を引き起こす可能性がある。
TPは抗生物質治療後の腸内細菌叢の多様性を著しく高め、腸内細菌叢のアンバランスを改善し、SCFAsのレベルを高め、がん、肥満、糖尿病など抗生物質に起因する疾患のリスクを低減する。
TPによる腸内細菌叢の調節は、抗腫瘍、抗肥満、免疫調節などの生物活性のメカニズムの一つであると考えられ抗生物質の悪影響を軽減する機能性食品添加物となる可能性がある。
TPは、大腸菌(E. coli)、連鎖球菌、バクテロイデスなどいくつかの病原性細菌の増殖を抑制することができる。
また、TPは細菌性リポ多糖の合成やがんに関連経路を減少させるで炎症性因子の産生を抑制し、大腸がんの発生を抑制する。
EGCGを介した大腸炎マウスの腸内細菌叢構成や代謝は、アッケルマンシア属の存在量や酪酸の生産量を増やすことで大きく変化し、大腸炎の症状も緩和される。
EGCGの経口投与により大腸の炎症性サイトカインIL-6、IL-1β、TNF-αのレベルが著しく低下し、抗酸化レベルが上昇、ビフィドバクテリウム、フィーカリバクテリウムなど8種類のプロバイオティクス属が存在量を増した。
・腸-脳軸ケミカルシグナル
短鎖脂肪酸と腸管神経細胞
腸内細菌は、免疫経路、神経経路、代謝経路を通じて脳や行動に影響を与える。
腸-脳軸神経回路の代表経路が迷走神経で、脳幹から腸、ENSに伸びている。
直接的なシグナル伝達の例として食物繊維の発酵により腸内細菌が産生する脂質であるSCFAがある。
動物実験では、微生物による食欲の制御が体重増加の違いの根拠として強調されているものもあるが、微生物によるSCFAsの制御が宿主の摂食行動にどのように影響するかは完全には明らかになっていない。
SCFA遊離脂肪酸受容体2および3は、ENS、門脈神経および様々な感覚神経節に発現しており、神経系の活性化がこれらの機能の調節に関与していることが示唆されている。
・腸内細菌叢が神経細胞の5-HT産生を誘導する
セロトニンとして知られる5-HTは、約95%が腸管由来で残りの5%は中枢の5-HTニューロンで合成される。
5-HTは、重要な神経伝達物質であると同時に分泌促進物質でもあり、消化管に存在する多くの生体機能にとって重要な調節因子。腸の分泌や運動調節を構成する。
また5-HTは免疫調節機能を持ち、粘膜免疫細胞と密接に相互作用する。
視床下部のエネルギーバランス調節機構にも5-HTエネルギー系が関与している。
ヒトやげっ歯類で食欲不振を引き起こし、一方、5-HTエネルギー系の抑制は食物摂取量を増加させる。
高脂肪食の長期摂取は、食後インスリンと視床下部細胞外領域の5-HTを減少させ、エネルギー代謝の障害と炎症反応の亢進をもたらす。
TPは5-HTのエネルギーシステムに影響を与えることなく、高脂肪食による視床下部の炎症を改善することができる。
バクテロイデス・フラジリス、ブルセラ属、変化したSchaedler菌叢などの特定の細菌株は、大腸と血清中の5-HTのレベルを変更する。
コリネバクテリウム、ストレプトコッカス、大腸菌は、生体内でトリプトファンを介して5-HTを合成する。
5-HTの変化を媒介する微生物は、腸内微小環境にも順次調節的な影響を及ぼしている。
腸内細菌叢の乱れは5-HTレベルのアンバランスを引き起こす一方、プロバイオティクスの摂取は5-HT機能不全の症状を緩和する。
・細菌叢と5-HTの相互作用は神経保護につながる
5-HTは神経伝達物質として、MGB軸のシグナル伝達経路に重要な役割を担っている。
ENSの5-HT4受容体の活性化は、成体神経の形成や神経保護に関係している。
5-HTは、神経新生や神経細胞の生存率の向上に無視できない役割を果たすと考えられている。
アルツハイマー病(AD)では、神経細胞の減少、脳萎縮、アミロイドβペプチド(Aβ)の脳内沈着、老人斑の出現、神経原線維のもつれなどが臨床的に明らかになる。
2011年の研究では、選択的セロトニン再取り込み阻害剤(SSRI)の使用や、細胞外の5-HTの量を直接増やすことで、マウスの脳組織液中のAβ含有量を25%減少させることができることが明らかにされた。
SSRIが5-HTの再取り込みを抑制することで脳内の5-HTの濃度を高め、Aβの凝集を減少させることを示唆する証拠が増えている。
2014年に行われた研究では、ラットの腸壁にα-Synを注入したところ、最終的にそのタンパク質が脳で見つかったことから、α-Synは腸の神経細胞と脳への輸送に伴う微細血管から拡散し、その後PDが起こる可能性が示唆された。
最新の研究では、認知症、AD患者、正常な腸内細菌叢をそれぞれGFマウスに移植したところ、前者には運動障害、消化管機能の低下、便秘が見られたことから、腸内細菌がPDやADの疾患に相関している可能性がさらに示唆された。
TPは血液脳関門を通過することができるため、脳の認知機能障害を改善することができる。
EGCGは神経疾患の細胞モデルおよび動物モデルにおいて、神経保護的な役割を果たすことが示されている。
5-HT遺伝子欠損マウスの空間学習・記憶能力は低下し、認知能力の低いストレスマウスの血漿5-HT濃度は著しく低下したが、TPの調節下ではストレスマウスの5-HT濃度は上昇し、認知機能は改善されている。
従って、腸内細菌叢の恒常性を調節し、TPとSSRIを適用して脳の海馬の5-HT濃度を改善し、Aβとα-Synの蓄積を弱めることは、神経疾患の管理に対する新しい治療オプションになると期待されている。
・腸内細菌叢-5-HTとうつ病、自閉症
近年の研究では、うつ病は5-HTと直接関係しており、現代の抗うつ薬は主に脳内の5-HT濃度の上昇や血小板による5-HTの取り込みを阻害することに焦点を当てて製造されている。
L-テアニンを経口投与すると、線条体、視床下部、海馬の5-HTとドーパミンの濃度を上昇させることができる。
ディスバイオーシスは様々な炎症因子の産生を伴う炎症を誘発し、それが循環経路を通じて中枢神経系に入り、グリア細胞内のミクログリアを活性化してうつ病エピソードを促進する。
うつ病患者および健常者の腸内細菌叢をそれぞれGFマウスに移植すると、前者はうつ病に似た行動をとり、腸内細菌叢の多様性が変化してうつ病患者の細菌叢と酷似することを示すことが報告されている。
5-HTの気分への影響は、急性トリプトファン枯渇法により研究されてきた。
この研究方法は、食事中のトリプトファンを減らすことで脳の5-HTレベルを低下させ、5-HT依存行動を分析するもの。
トリプトファンが豊富な食品と不足している食品をそれぞれ食べ、写真を使って被験者の憤りを増長させ、最終的に磁気共鳴イメージング技術を利用して脳の反応を観察する。
その結果、トリプトファン不足で体内の5-HT濃度が低下すると脳由来の怒り反応が抑えられなくなり、一方、脳の前頭葉と扁桃体の間の情報伝達が低下することが判明した。
前頭葉は怒りなどの感情をコントロールし、扁桃体は怒りに関係しているため、5-HTが不足すると前頭葉が怒りの感情を持つ扁桃体をコントロールできなくなるという見解がある。
自閉症は、先天性の発達障害を持つ乳幼児によく見られる疾患。
バクテロイデス・フラジリスやバクテロイデス・ポリモルファを投与すると、自閉症症状が改善されたとする研究がある。
また、最近の研究では、乳酸菌が腸の恒常性を維持し、自閉症の治療法を促進する能力を持つことが実証されている。
TPの抗うつ作用は、神経終末のシナプス前膜による神経伝達物質5-HTの再取り込みを阻害し、シナプス空間におけるモノアミンの濃度を上昇させることによると考えられている。
・腸内細菌叢-5-HTと炎症性腸症候群などの免疫疾患について
炎症性腸症候群の腹痛、腹部膨満感、便通の変化などの症状とともに、不安、抑うつ、イライラなどの精神的問題を伴うのはMGBシステムの過敏反応であると考えられている。
IBSや関連する精神疾患の腸内環境を改善するためにプロバイオティクスを使用することは、有効な介入となる可能性がある。
腸内プレバイオティクス、抗生物質、糞便移植などを用いて腸内フローラの多様性と安定性を改善し、IBS症状を改善する共生微生物(Clostridium、E. coli、Salmonella、Shigella、Pseudomonasなど)の比率を下げ、IBSやその他の5-HT関連MGB軸の擾乱の治療という目標を達成できる可能性がある。
・茶ポリフェノールの神経保護作用と抗炎症作用
血管性認知症は、様々な疾患により脳への血液や酸素供給が不足することで知的障害を伴う脳機能疾患で、ADに次ぐ認知症疾患とされている。
脳虚血や低酸素は、海馬の神経細胞のアポトーシスを容易に刺激して認知機能を低下させるが、いくつかの観察研究では、TP介入後、ラットの海馬のCA1領域のニューロンの形態は正常である傾向があり、Aβの沈着は減少し、ニューロンに対する保護効果があることが示されている。
PPs化合物は、抗凝集性を介して神経保護効果を発揮する可能性がある。
TPは、野生型α-Synの糸状凝集体の形成を阻害し、繊維状のα-Synを解重合させる。
EGCGは、α-Synフィラメントの形成を効果的に抑制し、また、大きな毒性α-Synフィラメントを小さな非毒性かつ非固定形タンパク質凝集体に変換する。
緑茶の摂取はグルタチオンペルオキシダーゼの減少を防ぐことができることから、緑茶が加齢による酸化的障害に対して保護効果を有することを示している。
現在豊富な証拠により、TPは神経保護および神経調節活性を持つ潜在的な生物活性物質であることが示唆されている。
高脂肪食ラットにEGCGを介入させると、C反応性タンパク質の発現レベルを有意に制御し、赤血球沈降速度および総白血球数を緩和し、さらに抗炎症作用を通じて動脈硬化の形成を抑制することが研究で示されている。
インスリン抵抗性ラットモデルでは、TPはインスリン、脂質代謝および炎症に関連するシグナル伝達を調節することにより、炎症性サイトカインの発現を防ぎ、抗炎症タンパク質の産生を高め、心筋への慢性炎症のダメージを緩和する。
LPS誘発ラット急性肺損傷モデルにおいて、EGCGはシグナル伝達経路を調節することで炎症性因子の発現を減少させ、肺における好中球の蓄積を抑制し、肺損傷に対する保護作用を有することが示されている。
まとめ
茶ポリフェノール、特にEGCGは、宿主の様々な疾患に対する複数の保護作用がある。
豊富な疫学研究と臨床試験により、TPの適切な補給は慢性神経疾患と関連する免疫疾患に対して明らかな保護効果を持つ。
TPの経口投与は生物学的利用能が低いため、臨床応用はまだ特徴のない多くの課題を抱えている。
EGCGを標的部位に効果的に送達する方法は、まだ不明である。
腸内細菌の代謝産物であるSCFAsと5-HTは、脳神経細胞と腸管神経細胞の間の密接な関係を構築する一種の伝達媒体であると提唱されている。
したがって、宿主とその関連細菌叢や代謝産物との共進化が、腸と脳との複雑な生物学的コミュニケーションをもたらしたと考えられる。