近年、腸内細菌叢と運動の関連性を指摘するデータが蓄積されている。
初期の研究では、運動が腸内細菌叢に及ぼす有益な効果が実証され、その後の研究により運動関連と健康な腸内細菌叢との間に正の相関があること、運動介入により有益な細菌群の存在量が増加することが明らかになった。
最近の研究では、運動パフォーマンスに対する腸内細菌叢の影響の探求に焦点が当てられている。
マウスを用いた研究では、特定の細菌群が乳酸代謝の様々な側面を増強することにより、エンデュランス系運動パフォーマンスを向上させる可能性があることが明らかになっている。
さらに、短鎖脂肪酸(SCFA)が骨格筋を含む様々な臓器の代謝を調節し、マウスのエンデュランス能力を高めることが示されている。
リンクのレビューは、腸内細菌叢と運動の関連について現在わかっていることをまとめている。
特に腸内細菌叢のエルゴジェニックな可能性と、それを活用したエンデュランス系運動能力の向上に焦点を当てている。
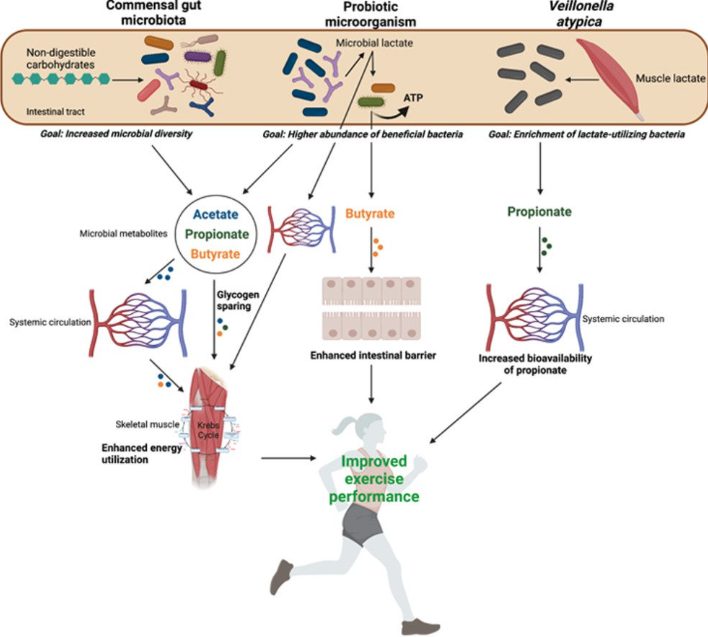
・腸内細菌叢は、宿主の1日の必要カロリーの約10%を供給する最近自身の代謝産物の生産を通じて、また食欲、脂肪蓄積、耐糖能に直接または間接的に影響を与えることで宿主のエネルギー代謝に影響を与えている。
腸内細菌叢は主要な代謝プロセスに様々な影響を及ぼす。
・動物モデルおよびヒトモデルの初期研究では、微生物の最適化を目標とした介入(すなわち、プロバイオティクス、プレバイオティクス、短鎖脂肪酸(SCFA)の補給)後に運動能力が向上することが示されている。腸内細菌叢がこれまで未解明だった運動パフォーマンスの決定要因である可能性を示唆しており、外因性の腸内細菌叢標的戦略はヒトの運動耐性、能力、およびパフォーマンスを向上させる新しいメカニズムである可能性を示唆している。
*腸内細菌叢
腸内細菌叢は約40兆個の細菌、ウイルス、古細菌、真菌からなる複雑な生態系。
主に大腸に存在し、そのバイオマスは約1.5kgに及ぶ。
細菌叢は消化管全体に生息し、胃の細菌数が最も少なく(101/グラム)、結腸の細菌数が最も多い(1012/グラム)。
ヒトゲノムの遺伝子が約23,000個であるのに対し、腸内細菌は約330万個の遺伝子を持ち、エネルギー代謝、炎症、ビタミン合成、免疫など宿主の機能のさまざまな側面を調節している。
*プレバイオティクス、プロバイオティクス、ポストバイオティクス
プレバイオティクス、プロバイオティクス、およびポストバイオティクスは、腸内細菌叢を調節する機能を有する物質群で「バイオティクス」と総称される。
有益な細菌種(プロバイオティクス)の存在量を増やすため、または既存の常在細菌種(プレバイオティクス)の健常性を増幅するためにプレバイオティクスおよびプロバイオティクスを使用することは、腸内細菌叢の構造および機能を改善するための外因性アプローチ。
乳酸菌とビフィズス菌の単独またはコンソーシアムブレンドの形で見られることが最も多い。
プレバイオティクスは、難消化性オリゴ糖、フルクタン、ガラクタンなどに含まれる。
ポストバイオティクスという概念は最近登場したもので、不活性化された微生物細胞または細胞成分を含み、SCFAsなどの代謝産物を含むか含まない。
*腸内細菌叢とSCFAs
腸内常在菌は食物繊維のような難消化性基質を短鎖脂肪酸SCFA-酢酸、プロピオン酸、酪酸-に発酵させることができ、これらは大腸の健康と健全性の維持に重要な代謝産物。
酪酸は大腸細胞の優先的な栄養で、腸管上皮で広範囲に酸化され、様々な局所的効果によって腸の健康を増進する。
酢酸とプロピオン酸も利用されるが、酪酸に比べれば酸化される程度は低い。
大腸細胞で酸化されなかったSCFAは門脈を通って肝臓に移動し、そこでクレブスサイクルの基質として利用されるか、あるいは全身循環に入り、いくつかの細胞や臓器で有益な作用を引き起こす。
最近の研究で、SCFAの標的臓器の1つは骨格筋で、骨格筋代謝に影響を及ぼすと考えられている。運動中のエネルギー代謝の役割を考えると、SCFAが骨格筋内の代謝プロセスに及ぼす可能性があることは興味深い。
*運動が腸内細菌叢に及ぼす影響
過去の研究では、
1)プロラグビー選手は高および低BMIの座りがちな対照群と比較して、アルファ多様性が高く、健康に関連するAkkermansia属の相対存在度が高いことが示されている。
2)運動は、α多様性の増加、有益な細菌群の増加、および糞便中のSCFA量の増加と相関している。
ことが明らかになっている。
*腸内細菌叢が持久系運動能力に及ぼす影響
2019年、エンデュランス系運動能力が微生物を介したメカニズムに影響を受ける可能性があることが初めて実証された。この研究で、ボストンマラソン参加者から提供された毎日の便サンプルをマラソン約5日前とマラソン後にrDNA分析を行ったところ、マラソン後の選手においてVeillonella属の相対存在量が有意に増加することが明らかになった。
Veillonella属は、乳酸を主な炭素エネルギー源とするグラム陰性菌。
マラソンでは骨格筋における乳酸産生(および除去)が著しく増加し、その結果、ATPの需要を満たすために解糖速度が高くなることが特徴。研究者は、高強度の持久系運動におけるVeillonella属のエルゴジェニック効果の可能性を探るためにVeillonella atypicaのヒト株を単離してマウスへ接種。乳酸を異化しない対照菌と比較して、Veillonella atypicaはトレッドミル走行時間を増加させ、乳酸代謝増強メカニズムによる影響が示唆された。
さらに、乳酸は腸に入り、Veillonella atypicaによって代謝され、SCFAであるプロピオン酸に変換されることが明らかになった。
その後、プロピオン酸は腸を出て肝細胞で代謝されるか全身循環に入り、骨格筋などのSCFA受容体を発現する末梢組織や臓器に影響を及ぼす可能性がある。
プロピオン酸のエルゴジェニック効果の可能性を探った実験では、プロピオン酸の直腸注入を受けたマウスは生理食塩水を投与したマウスと比較して、トレッドミルでの激しいランニングの走行時間が長くなった。
パフォーマンス向上の正確なメカニズムは依然として不明だが、プロバイオティクス介入後、身体能力、疲労、エネルギーアベイラビリティに関連するマーカーが用量依存的にマウスで改善されるという証拠もある。
*乳酸代謝における細菌叢の影響
上記のように、腸内細菌叢が運動パフォーマンスにプラスの影響を与えるという有望な証拠はあるが、腸内細菌叢とその代謝産物のエルゴジェニック効果の根底にあるメカニズムは依然として不明。
可能性の一つとして、乳酸代謝を増強する細菌を介したメカニズムが提唱されている。
歴史的に乳酸は疲労の原因物質として不当に扱われてきたが、現在では主要なエネルギー源および糖生成前駆体として認識されている。乳酸は体内のほぼすべての細胞で産生され、特に骨格筋は運動時に乳酸を産生・利用する主要器官。運動中に筋線維で産生された乳酸の大部分は主に赤筋線維で消費されてATPを産生する。新たに産生されたグルコースは全身循環に入り、運動中の骨格筋の解糖系基質として利用できる。
運動中の組織による乳酸の取り込みと利用の代謝的重要性を考えると、乳酸代謝メカニズムは、運動能力およびパフォーマンスに有益な効果をもたらすと考えられる。
したがって、理論的に腸内細菌叢(Veillonella atypicaの存在)は、肝臓や骨格筋の酸化組織と並んで乳酸の消費器官として機能し、運動中のエネルギー供給を最適化できる可能性がある。
・研究デザインが完璧ではないものの、プロバイオティクスの摂取が抗疲労効果および/またはエネルギー供給を強化する生理学的メカニズムを通じて、運動パフォーマンスを増強する可能性を提唱する研究者もいる。Lactobacillus属とBifidobacterium属は、難消化性糖質を発酵させて乳酸を生産する乳酸菌(LAB)グループで、生産された乳酸はAnaerostipes caccaeやEubacterium halliなどの乳酸利用菌によって消費され、アセチルCoA、さらには酪酸を生成し、それに伴ってATPが産生される。したがって、腸内の乳酸産生菌の数を増やすと、酪酸(ひいてはATP)産生菌の基質利用率が高まり、エネルギー利用率が上昇して疲労を遅らせることができるかもしれないという。
・プロバイオティクス補給後に観察されるエルゴジェニック効果に関する仮説の一つに、腸内のLABの量を増やすと微生物による乳酸の生産が増加し(食物繊維を十分に摂取していると仮定)、それが骨格筋などの消費組織で利用されるようになる、というものがある。
腸内のLABによって生産された乳酸は、ナトリウム結合モノカルボン酸トランスポーターを介して大腸から全身循環に輸送され、運動中に骨格筋に取り込まれて酸化される可能性があるという。
エネルギー源としての乳酸の価値を考えると、乳酸菌またはビフィズス菌の介入によって乳酸のバイオアベイラビリティを高めることは、理論的にはエネルギー代謝を最適化して持久運動能力を増強する可能性がある。
*腸内細菌叢、グリコーゲン貯蔵量および骨格筋代謝
・プロバイオティクスを摂取すると、グリコーゲン貯蔵能力が向上することが実証された。
筋グリコーゲンの枯渇は、長時間の激しい運動時に運動パフォーマンスを制限する主因。
グリコーゲン貯蔵量を最大化するための最も一般的な方法は、おそらく「カーボ・ローディング」だが、高炭水化物摂取は胃腸障害を引き起こす可能性があり、いくつかの研究でカーボローディングは女性にはあまり効果がない可能性があることが示唆されている。
グリコーゲンの貯蔵量を補充し、炭水化物を標的としたアプローチに依存せずにグリコーゲンを確保する介入は魅力的。
・グリコーゲン貯蔵能と骨格筋代謝に対する細菌叢の影響はマウスモデルで実証されており、SCFAの代謝作用に起因するようだ。
Lactobacillus属およびBifidobacterium属は難消化性炭水化物を発酵させてSCFAを産生する。
SCFAが骨格筋におけるGLUT4の発現を増加させることでグリコーゲン貯蔵能力を高め、グルコースの取り込みおよびグリコーゲンの再補充を増加させることが最近の研究で実証されている。
さらに、SCFAは肝臓と骨格筋における脂質および糖質代謝に影響を与えることが示されている。
SCFA、特にプロピオン酸は糖新生の前駆体として利用され、運動中の骨格筋に追加基質を提供することで運動中のエネルギー需要をサポートする。
また、SCFAは有酸素運動トレーニングによって誘導される表現型に類似した骨格筋代謝を調節することが示されている。
現在利用可能な証拠から、SCFAがグリコーゲン貯蔵および骨格筋代謝への影響を通じてパフォーマンスを向上させる効果があるらしいことがわかった。しかしながら、そのエルゴジェニックな可能性の基礎となる正確なメカニズムは依然として不明。
要約
1)腸内細菌叢が持久系運動能力および耐性に影響を及ぼすことを強調している。
2)腸内細菌叢とその代謝産物は、乳酸代謝の増強、グリコーゲン貯蔵量の増加、骨格筋の基質代謝に影響を与えるメカニズムによって運動能力を高める可能性がある。
3)Veillonella atypicaと乳酸菌は乳酸代謝に影響を与える可能性がある。
4)短鎖脂肪酸は骨格筋基質代謝を調節する可能性がある。
5)プレバイオティクス、プロバイオティクス、ポストバイオティクスは、エルゴジェニックな可能性を持っている可能性がある。