近年、腸内細菌叢(GM)と健康の関連性について熱心に研究が行われている。
腸内細菌叢は消化器系疾患だけでなく精神疾患にも関連する可能性があり、特に「細菌叢-腸-脳軸」と表現される双方向コミュニケーションによる腸内細菌叢と脳機能の関係において、ストレス、送達形態、プロバイオティクスの役割、概日リズムシステム、食事、職業・環境曝露といった要因の重要性が強調されている。
リンクのレビューでは、腸内細菌叢と神経系との間の様々な経路(神経伝達物質、内分泌系、免疫機構、あるいは細菌代謝物)が関与する腸内細菌叢と脳および宿主反応の関連について論じ、大うつ病性障害(MDD)、統合失調症(SCZ)、双極性障害(BD)、自閉症スペクトラム障害(ASD)、注意欠陥多動性障害(ADHD)などの精神疾患発症におけるマイクロバイオータの変化とその結果について概説している。
The Microbiota–Gut–Brain Axis in Psychiatric Disorders
・腸内細菌叢の役割
まず腸内細菌叢は腸の機能を正常に保ち、適切なpH、適切な腸の蠕動運動、規則的な排便リズムを確保している。腸内微生物は消化酵素を分泌したり、複雑な栄養素をより単純な有機化合物に変換したり、脂肪の代謝など食物の消化に関与するだけでなく消化された食物の吸収にも関与している。
さらに上記の機能に加えて、主にビタミンB群を合成する役割を担っている。
腸内細菌は難消化性糖質(主に食物繊維)の嫌気性発酵により短鎖脂肪酸(SCFA)を生産し、大腸の上皮細胞(コロノサイト)の主要なエネルギー源となっている。
腸内細菌叢のもうひとつの重要な役割として、毒素や発がん性化合物を中和することが挙げられる。
さらに腸内細菌は腸管バリアーを形成し、病原因子の侵入から宿主を保護している。
加えて重要な側面として、腸内細菌叢が免疫調節機能を持ち、消化管のリンパ組織との相互作用によってサイトカインのレベルを調節するなど、人体最大のリンパ系器官と考えられていることが挙げられる。
以上を総合すると、腸内細菌叢の量や組成の乱れ(腸内細菌叢異状:ディスバイオーシス)は、腸の蠕動運動の乱れ、消化吸収の障害、ビタミン産生または代謝の障害、脂肪の消化困難など多くの異常をもたらすだけでなく、腸管バリアの破壊や免疫系の過剰な刺激につながることは疑いようがない。
精神疾患におけるGM組成に関する過去のメタアナリシスでは、腸内細菌の数や分布(α-diversity)に強い差がないことが明らかにされているが、大うつ病性障害(MDD)、統合失調症(SCZ)、双極性障害(BD)においては対照群と比較して、組成の違い(β-diversity)が認められている。
・腸内細菌叢に影響を与える因子
腸内細菌叢と中枢神経系との双方向コミュニケーションは、子宮内胎児期に始まり、経膣/帝王切開出産、生活習慣、居住環境(都市/農村)、食事や医薬品の摂取、宿主の概日時計など多くの内因性/外因性要因に影響される。
分娩様式
「無菌子宮ドグマ」によるとヒトの胎児は出産まで無菌で、微生物は出産後にコロニーを作り始めると考えられてきた。
一方で最近の研究では、乳児の微生物叢のコロニー形成が胎内で始まっていることが示されている。大腸菌、Enterococcus faecium、Staphylococcus epidermidisによる乳児のコロニー形成は、母親の腸から血流や胎盤を経由したトランスロケーションと関連している可能性がある。
胎盤と羊水腔で観察される微生物 叢は、豊富さと多様性が低く、Proteobacteriaが優勢であることが特徴とする研究もある。
新生児の消化管コロニー形成に影響を与える重要な要因は分娩様式との考え方が主流になってきているが、ここ数十年、医学的な推奨がないにもかかわらず世界的に帝王切開術(CS)が増加しており、国によっては出産の50%以上が帝王切開で行われている。
これまでの研究で、経膣分娩(VD)児の腸内細菌叢の構成は、母親の膣内細菌叢と類似していることが示されている。
乳酸菌が優勢、セナチア属やプレボテラ属が乳酸菌に続き、そのほとんどが嫌気性菌で構成されている。
CSは乳児の腸内細菌叢のアンバランスと多様性減少につながる。
母親の膣内細菌叢と接触する機会がないため、病院施設と母親の皮膚が最初の接触となった結果、病院環境に由来する病原体(Enterococcus、Enterobacter、Klebsiella)が腸内で発見されている。
CS分娩児の腸内細菌叢は、Bifidobacteria、Bacteroides、Staphylococcus、Corynebacterium、Propionibacterium spp.が少なく、Propionibacterium spp.は多く含まれている。
また、VD児と比較して、Lactobacillus属、Prevotella属、Sneathia属、Clostridium difficile属が多く検出されている。
C. difficileの多さはディスバイオシスを引き起こし、肥満の発症リスクを高める可能性がある。
したがって、GMコロニー形成はその後の代謝、免疫系機能、脳の適切な発達など乳児の健康と発達に重要。
プロバイオティクス、プレバイオティクス、シンバイオティクスを乳児の食事に補充することで、乳児の腸内を微生物で最適にコロニー形成するための研究がさらに必要だろう。
ストレスと妊婦の膣内細菌叢、乳児の神経系発達との間に関連性を示す報告もある。
妊婦がストレスにさらされることで膣内細菌叢の組成が変化し、子孫の神経系の発達に影響を与える可能性がある。これは、新生児の腸内細菌叢の発達に乱れをもたらす結果、消化器系機能や発達だけでなく、神経系や免疫系にも影響を与える。
プロバイオティクス
プロバイオティクスは、うつ病、不安神経症、自閉症、統合失調症、双極性障害など、腸管透過性の上昇が確認されている精神疾患/神経疾患/発達障害の有効な治療法として多くのデータが示されている。
プロバイオティクスの作用機序としては、免疫系の調節、SCAFsの産生、腸管バリアーの完全性のサポートなど。
研究では、脳に影響を与えるプロバイオティクス菌株の多様性と特異性が明らかにされている。
メタアナリシスでは、うつ病患者のプロバイオティクス摂取がその症状を有意に緩和したと報告された。
また、Lactobacillus helveticus R0052とB. longum R0175を含むプロバイオティクスを30日間摂取するとうつ病や不安の症状が緩和され、プラセボを摂取する対照群と比較して、病院不安・うつ尺度(HADS)の割合が減少することを示した研究もある。
別の解析では、B. longum、Bifidobacterium animals lactis、Streptococcus thermophilus、Lactobacillus bulgaricus、L. lactis、L. helveticusなどの特定の株がストレスレベルを下げ、うつ症状を軽減することが明らかにされた。
さらに、プロバイオティクスのポジティブな効果はASDの子どもたちにも観察されている。
ASDの子どもにプロバイオティクスを補給することで、炎症が減少し、行動障害が緩和されることが示された。
SCZ患者では、胃腸の炎症と食物抗原による免疫活性化の関連性が示されている。
SCZ患者にビタミンDを12週間投与し、Lactobacillus reuteri, L. fermentum, L. acidophilus, Bifidobacterium bifidumなどのプロバイオティクス株を併用すると、PANSS(Positive and Negative Scroll)総合スコアに有益な効果があることが明らかになっている。
最近の興味深い話題は、COVID-19中の気分の改善に対するプロバイオティクスの影響。
プロバイオティクスは腸内バランスを回復させるだけでなく、日和見病原体による腸内コロニー形成のリスクを低減させる。
COVID-19感染は心的外傷後ストレス障害(PTSD)を引き起こす可能性があることが報告されており、SARS-CoV-2感染による腸内細菌叢異常は、腸内栄養素の不適切な輸送を引き起こす。
ある調査では、COVID-19患者による独自のプロバイオティクス製剤(1日あたり2400億ずつ3回投与)が、病気の重症化リスクを減少させることが明らかになった。
この製剤は、Streptococcus thermophilus DSM 32345, L. acidophilus DSM 32241, L. helveticus DSM 32242, L. paracasei DSM 32243, L. plantarum DSM 32244, L. brevis DSM 27961, B. lactis DSM 32246 および B. lactis DSM 32247から構成されていた。
注)プロバイオティクスの補給には注意が必要で、例えば、副腎皮質ステロイドで治療を受けている免疫不全の患者には推奨されない。
ストレス
心理学では、ストレスと精神疾患発症リスクとの間に明確な関係が示されている。
例えば、ストレス刺激による障害、特に長期的な影響を持つ障害とうつ病との間には、有意な関連があることが実証されている。
特に、小児期における様々なストレス要因は感情障害や不安障害などの精神疾患の発症リスクを高める。この現象のメカニズムには、視床下部-下垂体-副腎軸(HPA)の機能不全が深く関与する。
概日時計リズム
腸内細菌叢と宿主の概日時計の関係も興味深い。
概日リズムは、ほとんどの生物に存在する固有リズムで、全身で起こるさまざまなプロセスを整えている。
概日時計システムは、視床下部の視交叉上核(SCN)に置かれた中枢概日時計と、腸、膵臓、心臓、肝臓、骨格筋、腎臓などの組織にある末梢概日時計から構成される。
GMには日内変動があり、位相差(時差)、交代勤務、光、睡眠、食事栄養、ストレスなどの影響を受ける。
前述のように、ストレスは人間の生体に多大な影響を及ぼし、腸内細菌叢の調節異常を引き起こす。社会的ストレッサーに2時間でもさらされると、大腸粘膜の微生物集団に影響を与えることが実証されている。その変化には、大腸で免疫調節機能を持つラクトバチルス属の相対量および絶対量の減少が観察されている。
精神疾患や代謝異常がサーカディアンリズムと関連していることを指摘する研究者もいる。
概日時計システムの中断により、脳信号が腸の末梢時計を巻き込むことで腸内細菌叢の異常、細菌の転座、代謝性疾患リスクが高くなる炎症の発生を引き起こす。
シフト勤務やイブニングクロノタイプ(夕方に活動することを好む)などの要因が、BDやMDDの頻度の増加や増強と関連していると報告する研究もある。
また、腸管で分泌されるメラトニンの存在により、Enterobacter aerogenesの培養液の群発量が増加することが明らかになった。この細菌はヒトの消化管内に存在する常在菌。この同調の正確なメカニズムはまだ十分に解明されていないが、宿主の概日リズム系が細菌時計からのシグナルを通じてマイクロバイオームを制御している可能性を示している。
また、腸内細菌叢は肝臓の時計再プログラムと概日リズムの恒常性に重要な役割を果たす。
職業・環境曝露
GMに影響を与えるもう一つの要因は、職場における職業性被曝。
初期論文は、綿織物工場や畜産農家の労働者を対象にしている。個人は人生の大半を労働に費やすため、職場で発生する化学的、物理的、生物学的な危険への職業的暴露は、微生物叢を決定する重要な要因になる。
労働者のマイクロバイオームの変化を引き起こす最も危険な要因は、生物学的要因(動物や医療従事者との直接接触)、化学的要因(金属加工液、粉塵、農薬)への曝露、仕事のプレッシャー、長旅や微気候の結果としての栄養習慣の変化などであることが明らかにされている。
航海(30日間)の後、船員のマイクロバイオームが変化し、Streptococcus gordoniiとKlebsiella pneumoniaeという種が増加した。
シフト勤務の労働者では、夜勤者のサンプルではFirmicutesとActinobacteriaが増加し、Bacteroidetesが減少。Dorea longicatenaとDorea formicigeneransがより多く検出された。
日勤者ではFaecalibacteriumが多く検出された。
環境汚染物質リスクは、職業的な曝露に加えて、人間活動、農業、工業によって生じる。
ゼノバイオティクス(外来物質)には、重金属、農薬、除草剤、多環芳香族炭化水素(PAHs)、ポリ塩化ビフェニル(PCBs)などが含まれる。
環境中に存在する重金属はGM組成を変化させ、人間の健康に影響を与える可能性がある。
微生物叢と脳への有害物質の影響は、汚染物質の投与量と暴露年齢に依存する。
有機リン系農薬であるクロルピリホス(CPF)の早期暴露は、男女ともに慢性的なミクログリア調節障害を引き起こし、神経変性を加速させるため、アルツハイマー病(AD)のリスクを高めるとする研究もある。
廃棄物や燃料の不完全燃焼により生成されるPAHsは、タバコの煙や焼肉に含まれる。喫煙により、非喫煙者に比べて喫煙者はバクテロイデーテス門の割合が増加し、ファーミキューテス門とプロテオバクテリア門が減少する。
禁煙後は時間を要するが、最終的には非喫煙者の状態に戻る。禁煙はGM組成の変化に関連する疾患の治療における最良の解決策である。
食事について
腸内細菌叢の多様性と豊富さに影響を与えると同時に、免疫反応を構築する重要な要因のひとつが食事。
ビタミン、ミネラル、多価不飽和脂肪酸(PUFA)、アミノ酸などの食事性栄養素は、健康な脳の構造と機能の維持に欠かせない。
これらは、様々な代謝経路、細胞シグナル伝達、グルコースと脂質の代謝、神経伝達物質の合成プロセスに関与する。
SCFAは、宿主が摂取する食物、特に食物繊維とともに運ばれる栄養素に基づく微生物叢の代謝産物。
研究によると、魚油を添加した地中海食(MedDiet)は、うつ病の症状を軽減できることが明らかになった。
高脂肪・低炭水化物食であるケトジェニック食で、体を脂肪代謝の方向に調節する。
いくつかの臨床研究によると、ケトジェニックダイエットはAD患者に対して、高血中ケトン体濃度の解明を通じて、認知・記憶力を改善する効果を示した。
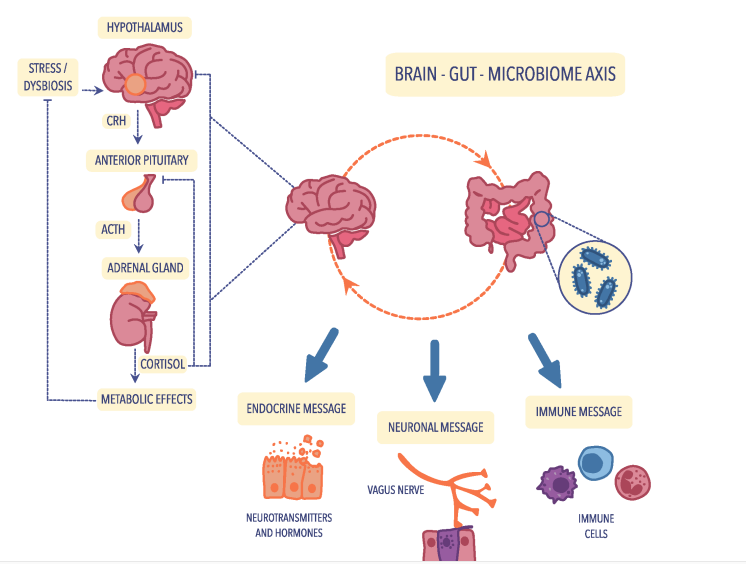
腸内細菌叢と神経系をつなぐ経路
視床下部-下垂体-副腎(HPA)軸
腸脳軸はいくつかのレベルで制御されているが、主な調節因子は神経および内分泌(HPA軸が主な役割)、免疫経路。
HPA軸の免疫制御は、主にサイトカイン分泌の修飾を介して行われる。
神経の調節は、主に迷走神経、求心性および遠心性線維、腸管神経系(ENS)などの自律神経系におけるインパルスの伝達を介して行われる。ENSは「腸の脳」と呼ばれ、1998年にコロンビア大学メディカルセンターによって初めて報告された。
腸管神経系は、消化管内の筋肉、粘膜、血管を直接制御し、その活動も担っている。
多数の神経線維で構成され、見事なネットワークを形成している。このシステムの機能には、30種類以上の神経伝達物質が関与していることは特筆に価する。
腸絨毛1本につき、約40個の神経細胞が存在する。
末梢神経系とは異なり、腸神経系の神経細胞はコラーゲンやシュワン細胞には囲まれておらず、代わりに中枢神経系のアストロサイトに類似したグリアに包まれている。
ENSは多数の伝達物質とサイトカインを通じて、腸管関連リンパ組織(GALT)および粘膜関連リンパ組織(MALT)の全身液性防御システムと密接に接触し続ける。
腸管神経系の神経伝達物質は、特にパイエル板とリンパ球の受容体に作用する。
GALTの大部分は免疫系全体のリンパ球(70%)で構成されて防御の第一線を担っており、特に外部抗原に対する免疫反応に重要な役割を担っている。
また、腸内に生息する微生物、ある種の細菌や真菌は、様々な神経伝達物質の合成と分泌を通じて、GALTとENSの両方にシグナルを伝達している。
脳と腸のコミュニケーションのホルモン制御は、主にストレス反応の経過を制御するHPA軸(ストレス軸としても知られる)を通して行われる。
視床下部ホルモン-コルチコリベリンは、バソプレシンと共にHPA軸に沿ってホルモンカスケードを開始し、下垂体前葉を刺激して副腎皮質ホルモンACTHを産生・分泌し、血液とともに副腎皮質に行き、コルチゾールを主とするグルココルチコイドを分泌するよう刺激する。
脳と腸、腸内細菌叢を強く結びつける腸脳軸は、迷走神経を中心とした自律神経系を介した脳と腸の双方向のコミュニケーション経路で、腸脳軸インパルスは、腸から脳への遠心性伝達が90%、中心性伝達が10%であることが明らかになっている。
迷走神経切断後も、腸は正常に機能することが多くの観察から証明されている。
神経内分泌経路
コルチゾールは、HPA軸に作用するサイトカインの分泌を調節することにより免疫系の細胞に影響を与えるだけでなく、腸内細菌叢の機能および分化に大きく影響するため、腸脳軸を制御する内分泌機構において重要な役割を担っている。
一方、特に注目すべきは、腸内細菌がγ-アミノ酪酸(GABA)など数多くの物質を産生することである(Lactobacillus spp, ビフィドバクテリウム属)、アセチルコリン(ラクトバチルス属)、セロトニン(エシェリキア属、キャンディダ属、エンテロコッカス属)、ドーパミン(バチルス属)、ノルアドレナリン(バチルス属、サッカロミセス属)等、多数の物質を産生していることに注目すべきである。
これらの物質は、腸内細菌叢内のコミュニケーションだけでなく、脳機能に影響を与える全身的・末梢的作用に関与している。
腸内細菌叢は、中枢神経系の主要な刺激物質の一つであるグルタミン酸(グルタミン酸)のレベルおよび代謝にも影響を及ぼす。
グルタミン酸は、グルタミン酸由来のグリア細胞で、グルタミナーゼの関与のもとに合成される。
グルタミン酸系で最も重要な受容体は、N-methyl-D-aspartate receptor (NMDA) である。
生理的な条件下では、グルタミン酸は学習や記憶の基礎となるものである。
そのため、記憶障害や神経衰弱の治療に広く応用されています。
しかし、このグルタミン酸が過剰になると、グルタミン酸受容体が過剰に活性化され、その結果、神経細胞を損傷してしまいます。グルタミンとグルタミン酸はともに、他の代謝経路で主要な抑制性神経伝達物質であるGABAに変換されます。
いくつかの研究では、腸内細菌叢がGABAのレベルだけでなく、その代謝にも影響を与えることが報告されている。
トリプトファン代謝
腸内細菌叢が脳腸軸に影響を与える具体例として、セロトニン合成が挙げられる。
中枢神経系におけるセロトニン欠乏は、うつ病、悲しみ、無気力、不安を引き起こす要因の1つ。
セロトニンは必須アミノ酸の一つであるトリプトファンが変化して生成される物質で、食事で摂取したトリプトファンの約2%がセロトニンに変換される。
体内では、消化管、神経系、免疫系でセロトニンが生成される。消化管ではセロトニンの95%が粘膜の好色細胞(ECC)、腸内細菌叢に属する微生物、腸の粘膜下層や筋層にある神経叢の神経細胞で産生される。血小板で3%、松果体で2%しか作られないことを考えると、消化管のセロトニン生産力には驚かされる。
神経系におけるセロトニンの主な機能は神経伝達で、セロトニン作動性ニューロンは、痛み、睡眠、気分転換、記憶プロセスの調節に重要な役割を担っている。
さらにセロトニンは、ENS における必須の伝達物質。
消化管におけるセロトニン受容体は、粘膜下層および筋叢のニューロンだけでなく、腸管細胞および平滑筋細胞にも存在する。セロトニンは受容体を介して、消化管の活動に作用(機能の抑制と促進の両方)する。
過去の研究では、セロトニン代謝の変化がある種の消化器系疾患の病因(炎症性腸疾患、消化管感染症、虫垂炎では血清セロトニン濃度の上昇)への関与が観察されている。
また、ビフィズス菌がトリプトファン濃度と代謝に影響を与え、体内のセロトニン濃度を上昇させることが研究で証明されている。
免疫学的メカニズム
近年、精神疾患の機序に炎症が深く関わることを示す証拠が増えてきている。
全身的な炎症反応を引き起こす要因の一つは、リーキーガット症候群(LGS)としても知られる腸管透過性の亢進がある。
LGSのメカニズムには、消化管内の腸内細菌叢の乱れ、腸細胞の損傷、腸細胞間の結合の弱まり、うつ病の病態生理で特に重要な役割を果たすストレスが含まれる。
多くの観察で、腸内細菌叢の乱れは腸管カンジダ症、クローン病、潰瘍性大腸炎、偽膜性腸炎、炎症性腸疾患などの多くの腸疾患の発症原因であり、さらに食物アレルギーや不耐症、あるいは大腸癌の発症原因ともなっている。
腸内細菌叢の量や組成の乱れは、腸内の病的状態や全身性疾患、アレルギー、肥満、メタボリックシンドローム、自己免疫疾患の発症を促進する。
炎症性サイトカインは、セロトニンの前駆体であるトリプトファンが代謝されるキヌレニン経路を活性化し、セロトニンの濃度に影響を及ぼすと言われる。炎症性サイトカインの濃度が上昇するとインドールアミン2,3-ジオキシゲナーゼ(IDO)が活性化され、トリプトファンやセロトニン(5-HT)濃度が低下すると同時に感情障害症状が強まり、トリプトファン異化物の濃度が上昇する。IDOの影響により、トリプトファンはキヌレニン、キノリン酸、3-ヒドロキシキヌレニンに変換され、セロトニンの産生が減少すると同時に中枢神経系の毒性代謝物濃度が上昇する。
細菌代謝産物
短鎖脂肪酸などの腸内細菌代謝産物は、主に食物繊維の嫌気性細菌発酵により生成される炭素数1〜6の脂肪族テールを持つカルボン酸。
SCFAsの95%以上は酪酸(butyrate)、酢酸(acetate)、プロピオン酸(propionate)で、少量ながら乳酸も検出される。
SCFAs産生菌は、Clostridium属、Eubacterium属、Fusobacterium属、Butyrivibrio属、Megasphaera elsdenii, Mitsuokella multiacida, Rosburia intestinalis, Faecalibacterium prausnitzii、Eubacterium halli。
SCFAは人体内で大腸菌やカンピロバクター属菌、サルモネラ菌などの病原性細菌の増殖を抑制する一方で、腐敗菌の増殖を促進する。サルモネラ菌などの病原性細菌を抑制し、菌の繁殖を促進する。また腸管上皮の治癒を促進したり腸管上皮の粘液の生合成を促進し、腸内のpHを適正に保つことで、腸内細菌叢の乱れから消化管を保護する。
さらに、SCFAは正常な腸内細菌叢の発達を促すイヌリンの吸収を抑えるなど、適切な腸内バリアの維持をサポートする。SCFAはまた、腸管上皮における炎症性メディエーターの活性を阻害し、抗炎症サイトカインカスケードをブロックしながらIL-8分泌を減少させることで、抗炎症効果を発揮する。
SCFAを産生する微生物の不在は、複数の脳障害を引き起こすと考えられている。
アキセンティックマウスを用いた研究では、細菌性微生物叢を欠くマウスは、ミクログリア細胞の発達に深刻な障害を示す。
一方、非常に多様な組成の微生物叢をマウスにコロニー形成させたところ、ミクログリア細胞の機能が大幅に改善されることが観察された。
SCFAをマウスに投与したところ、ミクログリア細胞の機能も改善することも観察された。
細菌性微生物叢を欠くマウスでは大脳皮質と扁桃体で脳由来神経栄養因子(BDNF)の発現が減少していた。
BDNFは精神疾患、特にSCZやMDDの発症に重要な役割を果たす因子と考えられている。BDNFの濃度低下が、認知障害、うつ、認知症、2型糖尿病の共通の発症因子であると指摘する研究がある。アルツハイマー病(AD)ドナーのサンプルでは、海馬でのBDNF発現の減少が示され、ADにおけるその役割が示唆されている。
また、SCZ患者は健常者と比較して血清中のBDNFタンパク質のレベルが低いことが示されている。
神経・精神疾患と腸内細菌叢
うつ病(大うつ病、MDD)
うつ病患者では、炎症に関連するアリスティペス属と、うつ病に関連するバレリック酸を持つオシリバクターレベルが上昇していることを示されている。
SCFAs 含有量の測定は、MDD 患者の微生物叢組成の分析に役立つと考えられる。SCAFsプロファイルに関する研究では、健常者と比較してプロピオン酸が低く、イソカプロン酸の含有量が高いことが明らかにされた。
また、他の動物モデルを用いた研究では、腸内細菌叢の組成と不安や抑うつなどの性格や行動との関連性が明らかにされた。内気な性格のスナネズミ(Meriones unguiculates)に、大胆な個体の腸内細菌叢を移植するとその行動が変化した。内気なスナネズミが「大胆な糞便微生物叢」移植後に大胆な行動をとることが多く、腸内細菌叢と宿主の性格の関連性が示唆された。
統合失調症 (SCZ)
統合失調症は、情緒障害、職業障害、認知障害を含む多因子疾患で、成人のSCZ患者は心血管系疾患、代謝性疾患、感染症により早期に死亡する危険性がある。米国におけるSCZ患者の平均的な潜在的生命喪失年数は28.5年と推定される。
SCZで重要なのはドーパミンの関与だが、最近の知見では、ドーパミンはこの病態生理においてかなり間接的な役割と考えられる。SCZの原因は、他の神経伝達物質との関連にあるはずと考えられるようになった。
ある研究では、免疫/炎症プロセスとSCZの病因との関連性が指摘され、アラーミンと呼ばれる宿主ペプチド/タンパク質がシグナル伝達経路を活性化し、多くの感染誘発性または無菌性の炎症性疾患を発症させることを明らかにした。
グルタミン酸系の重要な役割を指摘する証拠も増えている。
双極性障害(BD)
双極性障害(BD)の病態生理には、免疫炎症活性の変化、酸化ストレス・ニトロソ化ストレス(O&NS)、神経調節物質トリプトファン異化物(TRYCATs)の関与が指摘されている。
あるメタアナリシスでは、BD患者の脳脊髄液(CSF)または血清/血漿中のTRYCAT濃度は、健常対照群に比べ低いことが示された。
さらに、BDの発症には腸内細菌叢の影響も考慮する必要がある。
BD患者のディスバイオシスと疾患進行の関連性も指摘されている。Coriobacteriaceaeの増加はコレステロール値の上昇と関連し、Lactobacilliの増加はBDに伴う肥満の発現に寄与する。
また、常在腸菌であるフェカリバクテリウムの量の少なさは疾患と相関する可能性がある。
BD患者では、SCFAsの生成につながる炭水化物の発酵に関与するClostridiaceaeの数が、対照群に比べて4倍も少なかった。
自閉症スペクトラム(ASD)
腸内細菌に関連する神経発達疾患の中で、最も重要かつ危険なものの一つが自閉症スペクトラム障害(ASD)。CDCのAutism and Developmental Disabilities Monitoring Network(ADDM)の推計によると、米国では約44人に1人の子供がASDと診断されている。ASDは、型にはまった行動、コミュニケーションや人間関係の構築の難しさ、環境の感覚信号に対する過敏な反応などを特徴とする。遺伝的要因、GI異常、炎症、あるいはその他の個人的・外的要因(出生前後の曝露、ストレス、GIマイクロバイオータ、食事など)を指摘する研究もあるが、いずれも本疾患を絶対的に解明できるものではない。
3歳から12歳の自閉症児40人のうち、82.5%に消化器症状がみられたという研究もある。
ASDと診断された患者では、FirmicutesとBacteroidesの比率、Firmicutes、Bacteroidetes、Fusobacteria、Verrucomicrobiaの門数に関連したディスバイオーシスが証明された。
ASD患者では、SCFAや揮発性有機化合物(VOC)レベルも影響を受けていることが明らかにされ、トリプトファンの代謝物でありセロトニンやメラトニンの前駆体であるインドールも含まれていることが判明した。
しかし、ASD患者における抗生物質治療や個人の食事の影響が考えられるため、慎重に解釈する必要がある。
注意欠陥多動性障害 (ADHD)
神経発達障害のひとつである注意欠陥多動性障害(ADHD)は、3~17歳の600万人の子どもたちが罹患している。
腸内細菌叢-腸-脳軸との関連を示すエビデンスも増えている。
96名の被験者を対象とした研究では、ADHD群では放線菌門がより多く存在する(例えば、ビフィドバクテリウム)一方、ファーミキューテスの存在量は減少していた。
またADHD群のマイクロバイオームでは、ドーパミン前駆体(フェニルアラニン)の合成に関わるシクロヘキサジエニルデヒドラターゼ(CDT)の産生能力がより顕著であることが判明した。
他のメ研究では、ADHD患者は健常対照者と比較してBlautiaのレベルが高かった。
この微生物は、代謝性疾患や炎症性疾患、生体内変換において調節的な役割を担っている。
神経精神疾患発症リスクは、幼少期のプロバイオティクス補給によって軽減される可能性がある。Lactobacillus rhamnosus GGの早期投与がADHDのリスクを減少させる可能性があることが示されている。L. rhamonsusは迷走神経を介して、マウスの情動行動と中枢のGABA受容体の発現を調節していた。
食事パターンがADHD患者に与える影響も重要。
食品には人工着色料が含まれているため、ADHD患者の多動性行動を減少させるには、そのような製品を食事から排除する必要がある。
オメガ3系PUFA、特にドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)の摂取も重要で、どちらも適切な膜流動性、神経伝達、受容体機能に不可欠。
ADHDの動物雄モデルを基にした研究では、オメガ3PUFAを豊富に含む食事を与えることで、衝動性の低下と集中力の向上が確認された。
パンデミックにより、精神疾患に罹患する人が増加している。
様々な精神障害者において腸内細菌叢が変化していること、腸内細菌の異常が炎症の発生に関連し、精神疾患の症状の形成や進行に関係していることを考慮すると、細菌種および薬や食習慣の影響に関する知識を広げる必要があることは疑いようがない。
これらの知識を広げることは、精神疾患に対する治療・保護戦略の開発やアプローチの創出に不可欠だろう。