1924年、オットー・ウォーバーグは自身が発表したがん細胞の代謝に関する論文の中で、「成長する組織の代謝は、成長しない組織の代謝とどのように違うのか」と問いかけた。
ウォーバーグはこの論文でがん細胞が代謝を再プログラムすることを報告し、論文発表から3年後に生体内で実証している。
この研究時の代謝の再プログラムの主な特徴は、酸素の存在下でがん細胞が成長していない細胞や臓器よりも多くのグルコースを取り込み、より多くの乳酸を合成することだった。
この再プログラムの重要な機能として、解糖系中間体や他の代謝物をヌクレオチド-RNA/DNA合成、アミノ酸-タンパク質合成、エピジェネティック修飾のためのアセチル基やメチル基合成などの同化反応に灌流することが挙げられる。
後に、このような好気的解糖は「ワールブルグ効果」と呼ばれ、嫌気的解糖である「パスツール効果」と対比されている。
リンクのレビューは、癌におけるワールブルグ効果について、そしてそれが同化作用とバイオマス生成のための基質提供にどのように役立っているかについて述べている。
また、筋肥大によってがん細胞と同様に代謝が再プログラムされることを示す証拠を検討している。
そして、このような代謝の再プログラミングが、2型糖尿病や肥満の予防や治療に役立つ可能性について論じている。
*ポイント
・オットー・ウォーバーグは、酸素の存在下でがん細胞がグルコースの取り込みと乳酸合成を増加させて代謝を再プログラムすることを発見し、これを「Warburg効果」と呼んだ。
・増殖中の健常細胞やがん細胞の代謝再プログラミングが、解糖系中間体やその他の代謝物を同化反応の基質として生成し、バイオマスの構築に役立つことが分かった。
・Myc、低酸素誘導因子、Pi3k-Akt-mTorは、がんにおける代謝のリプログラミングを制御するだけでなく、レジスタンストレーニングによって活性化され、筋肥大を刺激するシグナル分子である。
・筋肉が1グラムのバイオマスを構築するためには、グルコースやアミノ酸などの低分子基質を1グラム取り込む必要がある。
・筋肉質な生物やレジスタンストレーニングを受けた人が、痩せていてインスリン感受性が高いことが多いのはグルコースなどの代謝産物の取り込みのおかげかもしれない
Does a Hypertrophying Muscle Fibre Reprogramme its Metabolism Similar to a Cancer Cell?
*健常細胞や癌の増殖細胞はどのように代謝を再プログラムしているのか?
・ワールブルグ効果は何に役立つのか?
過去の研究により、癌における代謝リプログラミングの重要な機能は、解糖系中間体やその他のエネルギー代謝産物を同化作用の基質として生成することであることが明らかになった。
同化作用とは、『低分子量の前駆体から細胞成分」を合成する代謝の一部。
・具体的には、増殖中の細胞はより多くのグルコース、グルタミン、その他の小分子を取り込み、これらの分子を解糖やその他のエネルギー代謝反応に流し、それらは同化反応のための「フィーダー経路」となる。この同化反応には、DNAやRNAのヌクレオチドの合成、タンパク質合成のための非必須アミノ酸の合成、その他の高分子の合成が含まれる。
増殖細胞や成長細胞の代謝的再プログラムに関与するいくつかの重要な反応の概要を下に示した。
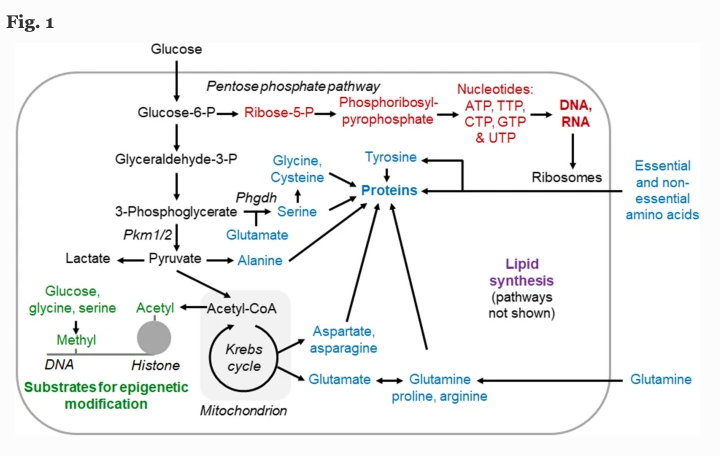
・最近の研究で代謝リプログラミングは癌によって異なり、厳密なプログラムではないことが示唆されている。例えば、240の癌のうち149のがんは解糖系遺伝子を過剰に発現していた。
2016年以降のより包括的な分析では、14のがん(70%)がプリン合成遺伝子を過剰発現し、10(50%)がDNA合成遺伝子を過剰発現し、7(35%)が酸化的リン酸化遺伝子を過剰発現し、解糖およびグルコネシス遺伝子はわずか5(25%)しか過剰発現していないことが判明した。
増殖細胞の代謝リプログラミングは様々であることが示唆された。
*筋繊維が肥大すると、代謝リプログラミングが起こるという証拠はあるのか?
・筋繊維は数千個の核を持つ非増殖性の合胞体(多核細胞)で、筋繊維の長さはヒトで最大20cmにもなる。増殖中の細胞はより多くのエネルギー代謝産物を同化作用に使用するように代謝を再プログラムしている。
・肥大化した筋繊維は増殖細胞と同様に代謝を再プログラムしているのかという問いに答える前に、増殖細胞と肥大化した筋繊維の同化作用における重要な違いを明らかにする。増殖細胞は、各細胞周期でゲノム全体を複製する必要がある。つまりヒトの各増殖細胞は、2つの娘細胞に分裂する前に、64億個のヌクレオチドとmRNAおよびリボソーム生合成用のヌクレオチドを合成する。
一方、肥大化した筋繊維は増殖中の衛星細胞に新しい筋核生成を「外部委託」しているため、mRNAとリボソーム生合成用のヌクレオチドしか合成しない。
RNAの五炭糖であるリボースとDNAの五炭糖であるデオキシリボースは、主にグルコースから合成されることが、増殖中の細胞がグルコースを多く取り込んでいる理由の一つ。
しかし、肥大化した筋繊維のリボソーム生合成では、リボソームの元となるヌクレオチドとrRNAを合成するために、グルコースも必要となる。
・増殖中のC2C12筋芽細胞と分化したC2C12筋管の細胞量に対する14C/13C-グルコースや14C/13C-グルタミンなどの放射性あるいは安定同位体トレーサーの寄与を比較検討した研究では、定常状態の増殖型C2C12筋芽細胞では、グルコースが15%、グルタミンが8%、6日間培養後の分化型C2C12筋管(肥大刺激は受けていない)では6%と3%が細胞量に寄与していることがわかった。
つまり、増殖細胞と肥大細胞はともに同化反応によってバイオマスを生成するが、増殖細胞のみが複製のためのDNAを合成する。
・肥大化した筋繊維は増殖細胞と同様に代謝を再プログラムしているのか?
・Myc、Hifタンパク質、Pi3k-Akt-mTorシグナルなどの制御分子は、レジスタンストレーニング後に発現が増加または活性化されるようになる。
特にMycとPi3k-Akt-mTorシグナルは、肥大化した筋繊維の代謝をリプログラミングするという証拠がある。
500mg/kgの2-デオキシグルコースで解糖を阻害すると、未処理のコントロールと比較して刺激後6時間の未処理および電気刺激したラット腓腹筋の基礎タンパク質合成が減少する。
これは、解糖系フラックスが筋肥大の主要な要因であるタンパク質合成を制限していることを示唆している。
・筋管肥大によって代謝がリプログラムされるという考えを裏付ける証拠が、培養した対照筋管とインスリン様成長因子(IGF-1)を導入した筋管とを比較した研究から得られている。
IGF-1を導入したC2C12筋管は、対照筋管に比べてタンパク質合成速度が2.7倍高く、幅も50%以上広くなり、IGF-1が筋管の肥大を促していることが示された。
また、IGF-1を導入した筋管では、乳酸脱水素酵素(遺伝子Ldh)の活性が3.2倍、乳酸濃度が2.4倍となり、IGF-1によりウォーバーグ的な代謝のリプログラミングが引き起こされたことが示唆された。
さらに、IGF-1はPi3k-Akt-mTor経路を活性化し、癌の代謝のリプログラミングに寄与していることが判明した。
・シナジスト切除によって達成された筋肥大、過負荷をかけたヒラメ筋において対照のヒラメ筋と比較してインスリン非存在下で解糖系フラックスを約60%増加させる。
・最近の発表では、過負荷が足蹠のグルコース取り込みをおよそ2倍にし、乳酸分泌を50%増加させ(しかし解糖系フラックスには影響なし)することが確認された。
・機械的負荷をかけたマウスの足底筋において、ペントースリン酸経路の律速遺伝子であるグルコース6リン酸デヒドロゲナーゼをコードするG6pdの発現が、ペントースリン酸経路の他の遺伝子とともに上昇することがわかった。ペントースリン酸経路は癌において活性化され、DNA、RNA、リボソーム生合成(リボソームは主にリボソームRNAから成る)のためのヌクレオチドを合成する。
・Pi3k-Akt-mTorシグナルが筋肥大だけでなく代謝リプログラミングも促進することを裏付ける証拠が、mTORC1阻害剤Nitrogen Permease Regulator2-Like Protein(Nprl2)をノックアウトしたマウスから得られている。
この場合も、グルコーストランスポーターGlut1をコードするSlc2a1の発現が3倍、ヘキソキナーゼ2をコードするHk2および乳酸脱水素酵素BをコードするLdhBの発現が2倍高くなることから、筋線維の肥大と有酸素性解糖を誘導していることが判断された。
・抵抗運動後、より解糖性の高いタイプ2筋繊維は、解糖性の低いタイプ1筋繊維よりも大きく肥大する。さらに、酸化的代謝と筋繊維の大きさが、同じ筋内の筋繊維間や異なる種の筋繊維間で逆相関していることから、筋肉の大きさと解糖・酸化的代謝の間に密接な関係があることが示された。
逆説的ではあるが、高酸化の遅い筋は、解糖の速い筋繊維よりもタンパク質合成装置の構成要素(すなわち、筋核密度やリボソームの高い含有量)を多く持っている。
タンパク質合成能が低いにもかかわらず、解糖系高速筋繊維の肥大能は高いのですが、これに対する納得のいく説明は今のところない。
・テストステロンがラットの筋管に及ぼす影響について調べた研究では、テストステロンは筋肥大を誘導し、解糖系酵素であるヘキソキナーゼとホスホフルクトキナーゼの活性を用量依存的に増加させ、ウォーバーグ的代謝リプログラミングと一致する。
・がんにおける代謝リプログラミングに関連する二つの酵素のうちの一つ、ピルビン酸キナーゼ筋(遺伝子PKM;EC 2.7.1.40)は解糖の最終段階であるホスホエノールピルビン酸からピルビン酸への変換を触媒する。PKMはPkm1とPkm2に交互にスプライシングされ、Pkm2は特に癌細胞や増殖細胞で発現し、非解糖系の調節機能を持つ。
In vitroでは、Pkm2をノックダウンすると筋管サイズが小さくなるのに対し、Pkm1をノックダウンするとC2C12筋管サイズが大きくなることから、Pkm2/Pkm1比が高いと筋管肥大が促進されることが示唆された。
・もう一つの酵素はPhgdhで、この酵素は解糖系代謝産物である3-phospho-D-glycerateをエネルギー代謝からセリン生合成経路に転換させる。
Phgdhは乳癌細胞の増殖を制限する酵素であることが判明している。
Phgdhの発現は、β2-アゴニスト刺激に応答して一過性に増加するが、ヒトの抵抗運動後には増加しない。
・上記を総合すると、少なくとも骨格筋肥大の一部のモデルでワールブルグ効果に似た代謝のリプログラミングが起こっている可能性がある。
レジスタンストレーニングを受けたヒトの筋肉では、解糖系遺伝子やがん代謝関連遺伝子の一般的な発現増加は見られないが、状況によっては解糖系酵素の発現が増加し、Pkm2やPhgdhなどのいくつかのがん初期化関連遺伝子が筋肥大を抑制する。
・無脂肪のヒト筋肉乾燥質量1kgあたり、約715gのタンパク質、約4gのRNA、約2gのDNA、そして結果として約279gの膜中のリン脂質などの分子で構成されている。
したがって、リボソーム生合成にはヌクレオチド合成が必要で、増殖中の衛星細胞では複製のためにヌクレオチドが合成されるが、定量的に最も重要なバイオマス生成プロセスは取り込まれたアミノ酸からのタンパク質合成、あるいは筋繊維が前駆体から合成したタンパク質合成となる。
*筋肥大時の代謝リプログラミングは健康に影響を与えるか?
・腫瘍細胞がグルコースを大量に取り込むことはオットー・ウォーバーグが最初に発見した重要な現象の1つだが、肥大した筋繊維は同様に多くのグルコースを取り込み、そのグルコースの一部を同化反応に回すのか?
仮に筋肥大によってグルコースの取り込み量が増えれば血糖コントロールが改善され、脂肪組織による脂質合成に利用できるグルコースの量が減るので、筋肥大は健康にプラスの影響を与えるはずだ。
循環から十分な量のグルコースやその他の小分子が除去されれば、筋肥大は糖尿病や肥満の予防や治療に役立つ可能性がある。
・筋肥大した筋肉がより多くのグルコースを取り込み、その結果、血糖コントロールが改善され白色脂肪組織が減少するという証拠がある。
下の画像は、「撮影の24時間前に激しい上肢運動(おそらくレジスタンス運動)を行った」患者の18F-フルオロ-2-デオキシ-D-グルコースポジトロン断層撮影スキャンを示したものである。
このスキャンは、運動後1日目の患者の大胸筋が多量のグルコースを取り込んでいることを示唆している。
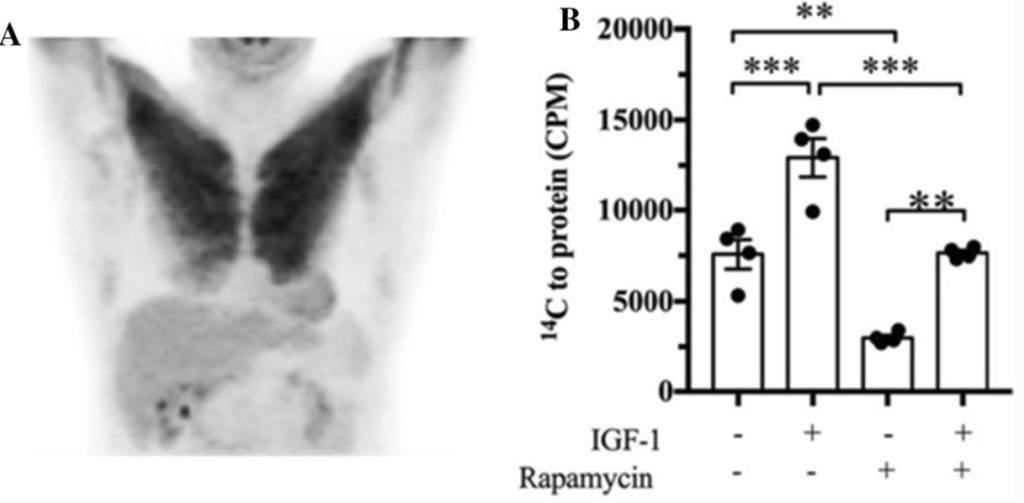
・取り込まれたグルコースが同化作用に使われるのか、それとも単に運動中に使われたグリコーゲンの再合成に使われるのかはわからない。
・別のコペンハーゲンの研究チームが、健常者と2型糖尿病患者のボランティアに6週間の片脚レジスタンストレーニングを実施させた研究では、トレーニング後、レジスタンストレーニングを行った脚はトレーニングを行っていない脚に比べて約25%(健常者)および約10%(2型糖尿病患者)多くのグルコースを取り込んだことがわかった。
・マウスでは、シナジスト切除によるヒラメ筋肥大は未処理の対照ヒラメ筋と比較して、すべてのインスリン濃度において、痩せ型および肥満マウスのグルコース取り込みと解糖系フラックスの両方を増加させた。さらに、過負荷で肥大化したマウスの足底筋は、対照の足底筋よりも約60%多くグルコースを取り込む。
・これらの研究を総合すると、レジスタンストレーニングを行ったマウスやヒトの筋肉、あるいは筋肥大した筋肉は、トレーニングを行っていない筋肉や筋肥大していない筋肉よりもグルコースを多く取り込んでいることが示唆される。
・筋肉がグルコースを同化作用、特にアミノ酸やタンパク質合成に使用することができるかどうかを具体的に調べた研究では、グルコース由来の14Cが筋タンパク質に取り込まれること、IGF-1による肥大刺激により、14C-グルコース→14C-解糖中間体→14C-非必須アミノ酸→14C-タンパク質という経路でタンパク質への14C取り込み速度が上昇すると推定されることが確認された。
逆に、ラパマイシンでmTORC1を阻害すると、タンパク質への14Cの取り込みが減少した。
・要約すると、肥大した筋肉はレジスタンス運動後少なくとも1日間はグルコースを取り込み、IGF-1による肥大刺激によってグルコースからの14Cの筋管タンパク質への取り込みが増加する。
これは、肥大した筋肉はより多くのグルコースとエネルギー代謝物を同化に使用するという考え方と一致している。
*肥大化した筋肉の代謝リプログラミングは、インスリン抵抗性を改善するのか?
・レジスタンス運動がグルコースの取り込みを刺激し、グルコース由来のエネルギー代謝産物を同化に向かわせるのであれば、レジスタンス運動はインスリン抵抗性を改善するはずである。実際、メタアナリシスでは、レジスタンストレーニングは糖尿病リスクのある人や2型糖尿病患者の血糖コントロールを改善すると結論づけている。
しかし、血糖値改善効果がグリコーゲン再合成の増加によって完全に説明されるのか、あるいはグルコースの一部が同化作用に振り向けられるのかは不明。いくつかの研究は、グリコーゲン減少運動によって引き起こされたのではない筋肥大がグルコースの取り込みを増加させ、これが抗糖尿病性であることを示唆している。
*肥大化した筋肉のウォーバーグ的代謝リプログラミングは抗肥満効果を持つか?
・筋肥大した筋肉がより多くのグルコースを取り込むのであれば、白色脂肪細胞による脂質のデノボ生合成に利用できるグルコースは少なくなるはず。その結果、筋肥大している生物は筋肉量が変化しないか減少している生物よりも痩せているはずで、これはしばしば事実である。
例えば、Akt1機能獲得変異やミオスタチン機能喪失変異により筋肥大化したマウスは、筋肉量が正常な対照動物よりも痩せている。
さらに、性腺機能低下または去勢された男性は、一般的に筋肉が少ないが脂肪組織が多く、性腺機能低下でない男性よりも頻繁にインスリン抵抗性を発症する。
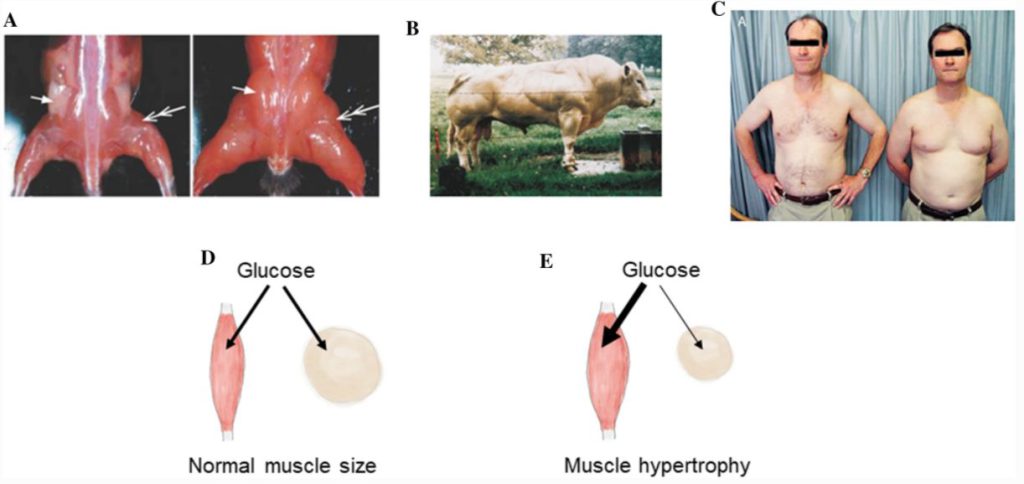
A 筋肥大マウスにおける脂肪パッドの損失。
導入遺伝子が筋肉に発現しているにもかかわらず、鼠径部脂肪パッドが消失している。
B 筋肥大を起こしたベルギーブルーの雄牛。
皮下脂肪が少ないことから、筋肥大と脂肪量の低さの関連性が示唆される。
C 右の双子が下垂体細胞腫のために性腺機能低下症になっている一卵性双生児の画像。
右の双子は「近位筋の消耗」が見られるが、左の無症状双子と比較すると体脂肪は多く、やはり筋肉量と脂肪量の逆相関が示唆される。
D, E 筋肥大がなぜ痩せるのかを説明する仮説の模式図。
正常な大きさの筋肉(E)と比較すると、肥大した筋肉にはより多くのグルコースやその他の低分子が取り込まれるため、白色脂肪組織でトリグリセリド(脂肪)を合成するためのグルコースが少なくなる。
・ある研究では、高脂肪・高糖分食のマウスにAkt1による筋肥大を誘導すると、体脂肪が減少することが示され、また他の研究では肥満の高齢男性に筋肥大を誘発するアナボリックステロイドを投与すると、腹部の脂肪が減少したことが確認された。
・一般的には、筋肉が成長するときまたは筋肉量が多いとき(例:青年、若年成人、ボディビルダー)は、筋肉量が安定しているとき、少ないとき、減少するとき(例:サルコペニアまたはテストステロン欠乏の人)よりも痩せる。
結論
増殖中の健康な細胞やがん細胞がエネルギー代謝物を同化反応に灌流し、メチル化やアセチル化などのエピジェネティック反応の基質を提供するために代謝を再プログラムしていることを示した。
肥大した筋肉はより多くのグルコースを取り込み、その代謝も再プログラム化し、グルコースの一部が同化経路に転用されるという証拠も提示した。
最後に、筋肥大した筋肉は、より多くのグルコースやその他の小分子を取り込み、これが抗糖尿病や抗肥満の効果をもたらすという証拠について説明した。
重要なことは、筋肥大はグリコーゲンを減少させる抵抗運動によって引き起こされなくても、インスリン抵抗性を改善し、抗肥満効果を持つ可能性があるということ。