近年、パンデミック下の生活様式の影響もあり、糖尿病の罹患率が増加傾向にある。
2024年には世界で約8億人が糖尿病に罹患すると予測されている。
遺伝的要因に加え、幼少期の発育環境も糖尿病の危険因子である。
妊娠前の母親の肥満、腸内細菌叢異常、妊娠糖尿病(GDM)、栄養不良、幼児期の短時間睡眠などの因子が子孫の成人後の代謝能力に影響を及ぼすことがわかっており、特に妊娠糖尿病と腸内細菌叢の子孫への影響の大さに注目が集まっている。
しかし注目が集まる一方で、妊娠中、周産期、出生後の長期にわたる子宮内高血糖環境が子孫に及ぼす影響の機序についてはまだ十分にわかっていない。
妊娠中の高血糖状態が周産期転帰に及ぼす影響を調査したHyperglycemia and Adverse Pregnancy Outcomes(HAPO)研究およびHAPOフォローアップ研究(HAPO FUS、9ヵ国15施設から多文化・多人種の妊婦を登録)では、出産後10年以上経過した段階で糖代謝異常が認められたGDM群の割合は50%以上にのぼり、対照群の20%に比べて有意に高いことが示されている。
また、GDMの母親とGDMではない母親の子供における耐糖能異常(IGT)の有病率は、それぞれ10.6%と5.0%で、母親のGDMは子供のIGT発症の独立した危険因子であることも判明し、母親のGDMとその子孫の小児肥満との間には有意な相関が観察されている。
トリグリセリド、脂肪酸、特異的ジグリセリドなど、脂肪新生に関連する脂質は正常血糖値の女性に比べてGDMの妊婦で上昇し、高血糖状態およびインスリン抵抗性の重症度と強く相関している。
腸内細菌叢は宿主の腸に定着しており、「第二のゲノム」として知られている。
ヒトの腸内細菌叢には約500~1000種の細菌が含まれており、腸内細菌叢の遺伝子数は約200万個で、宿主ゲノムの100倍である。
近年、腸内細菌が宿主の複数の代謝性疾患発症に関与していることを示唆する証拠が増えつつある。複数の研究で2型糖尿病(T2DM)患者における腸内細菌叢異常が証明されており、Clostridium hathewayiやEscherichia coliなどの病原性細菌の存在量が増加することがわかっている。
興味深いことに、患者の腸内細菌叢の特徴は糖尿病の経過を通じて変化する。糖尿病前段階では、対照群に比べてクロストリジウム属の存在量が減少しており、このことはグルコース代謝調節において宿主と腸内細菌叢の間に複雑な相互作用がある可能性を示唆している。
あるメタ解析では、GDM妊婦において腸内細菌叢のαおよびβ多様性が有意に減少することもわかっている。
介入研究ではプロバイオティクス補充後にGDM群の糖代謝が改善したことが報告されており、プロバイオティクス補充は女性のGDMリスクを低下させる可能性が示されている。
腸内細菌叢と妊娠中の糖代謝異常との因果関係はまだ不明だが、腸内細菌叢がGDM予防と母親の高血糖に関連した有害な妊娠転帰の改善の両方に重要な役割を果たしていることは否定できない。
リンクのデータは、GDMが腸内細菌叢を介して子孫の代謝に影響を及ぼすメカニズムと、腸内細菌叢の改善を目標とした早期介入に焦点を当てたもの。
臨床研究と実験動物モデルを要約し、子孫の糖代謝を改善しうる介入について考察している。有害な妊娠転帰が子孫のに深刻な影響を及ぼすことを考えると、早期介入によって子孫の糖代謝異常の悪影響を逆転させることは非常に重要だろう。
長文になってしまうがなるべく簡潔にまとめてみたい。
母親の代謝、腸内細菌叢、そして子孫の代謝
母子の代謝間と腸内細菌叢の関連性
胎児の腸内細菌叢の確立と影響因子
・新生児の腸内細菌は分娩時に母親から垂直感染するというのが一般的な認識だったが、研究が進むにつれて子宮は無菌環境であるという概念は崩れ、微生物叢は子宮内膜にも存在することが判明。子宮内プロファイルという概念の発見により胎児の腸内細菌叢の確立を説明できる可能性が広がったことになる。
・出生後の授乳方法も乳児の腸内細菌叢に影響を与える重要因子である。母乳育児を受けた乳児は、ビフィズス菌のコロニー形成が支配的な細菌プロファイルを特徴とする。母乳育児と比較して粉ミルク育児の乳児は腸内細菌叢にばらつきが見られるが、これは母乳中のオリゴ糖のプレバイオティック効果によるものと考えられる。母乳中のオリゴ糖は善玉菌の増殖を助け、ビフィズス菌が産生する酢酸や乳酸は大腸菌などの病原性細菌の増殖を抑える。母乳にはブドウ球菌、レンサ球菌、ビフィズス菌、乳酸桿菌などの細菌が含まれており、これらは乳児の腸内細菌叢発達のための継続的な供給源となる。
・乳児の腸内細菌叢の確立には、胎盤、臍帯血、羊水の微生物叢など様々な要因が複合的に関与しており、成人の比較的安定した微生物環境とは異なって乳幼児の腸内細菌叢は不安定である。成人と同様の安定した腸内細菌叢が確立されるのは3歳になってからである。したがって、乳幼児の発育初期の腸内環境は彼らの発育に大きな影響を与えやすい。
・肥満の母親から生まれた子供と痩せた母親から生まれた子供の腸内細菌叢に差が認められ、その差は1歳になっても観察される。生後6ヶ月の乳児の便中およびブドウ球菌レベルは、肥満の母親から生まれた乳児の方が高いことが観察されている。生後18ヶ月から27ヶ月の幼児にでも、肥満の母親とそうでない母親とでは糞便中のフィーカリバクテリウム属、ユーバクテリウム属、オシリバクター属、ブラウティア属の濃度が異なる。
母親の腸内細菌叢と子孫の健康の関連性
・正常な生理的条件下では腸内細菌叢が免疫系と代謝を制御し、栄養の恒常性に寄与している。腸内細菌叢のバランスが崩れると、肥満、糖尿病、心血管疾患など様々な有害代謝疾患の発症につながる可能性がある。
・胎盤と臍帯血を通じて母親と胎児の間で物質が交換され、胎児の初期成長と発育のための栄養サポートが行われる。したがって母親の代謝状態に何らかの変化が生じると、物質交換を通じて胎児の初期発達環境に影響を及ぼし、その結果成長過程における胎児の健康に影響を及ぼす可能性がある。
・中国の研究では、GDMの母親から生まれた乳児は胎便微生物叢のβ多様性が減少し、1歳時のBMI Zスコアが上昇していた。GDM群で枯渇したCo–abundance群は12ヵ月児のBMIと負の相関を示している。腸内細菌叢は、GDMの母親が胎児の発育に及ぼす影響において重要な媒介因子である可能性がある。
GDMと子孫の腸内細菌叢の動的変化
・妊婦73人(うち34人がGDM、39人が非GDM)を対象とした研究では、GDMと乳児の腸内細菌叢の動態との関係を調べるために、生後1ヵ月(M1)と6ヵ月(M6)の乳児の糞便微生物組成を分析。結果、GDM群と非GDM群でM1における多様性と組成に有意差はなかったが、GDM群の乳児の腸内細菌叢にはM6時点で11種が存在し、多様性レベルが低かった。また、M1からM6までのα多様性の動態はGDMの状態によって有意に異なっていた。このことは、出生後の腸内細菌叢のダイナミックな発達は母親の代謝状態と密接に関連していることを示唆している。
・腸内細菌叢の恒常性の確立と維持は代謝状態の維持に不可欠な因子として、子孫の生涯にわたる健康に影響を及ぼす可能性がある。
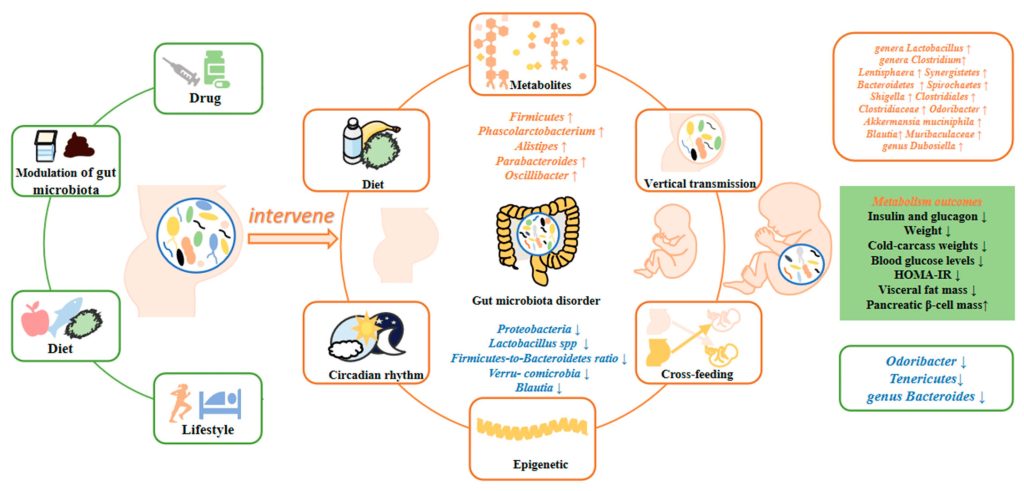
母親の高血糖が腸内細菌叢に影響を与え、子孫の代謝をプログラムするメカニズム
乳幼児期の腸内細菌の変化がその後の代謝に及ぼす影響
・乳幼児期における腸内細菌叢の初期コロニー形成は、その後の代謝に重大な影響を及ぼす。
縦断研究により、生後0ヶ月から3ヶ月までの乳児の腸内にはラクトバチルス属が多く、マイコバクテリウム属が少ないことは小児期の肥満や過体重リスクの予測因子であり、乳児期初期の腸内細菌叢組成の特徴が7歳時の体重と相関することが示されている。
・コホート研究、動物実験ともに高脂肪食(HFD)を子供に与えると腸内細菌叢の多様性が低下し、カンピロバクター・ジェジュニ(Campylobacter jejuni)とピロリ菌(H. pylori)が減少し、Trichospirillaceae属とクロストリジウム属(Clostridia)が増加することが示されている。
母親の高血糖は代謝産物を介して子孫の代謝をプログラムする
子孫のグルコース代謝における循環代謝産物の役割
・腸内細菌は腸内で栄養素を分解・代謝し、ビタミン、アミノ酸、短鎖脂肪酸(SCFA)などの物質を産生する。これらの代謝産物は腸から循環系に拡散し、肝臓、腎臓、脳など他の臓器の代謝に影響を及ぼす。
・中国の研究では、妊娠中期にGDMを発症した妊婦の糞便微生物叢と血漿メタボロームの変化が分析され、母親の糞便微生物叢の変化はGDM女性における血漿グリセロール、乳酸、プロリン、メチルマロン酸レベルの変化と関連していることが示された。
・GDM母子コホート研究では、GDM群の新生児は腸内細菌叢の多様性が低下していただけでなく糞便中のいくつかの代謝産物も変化しており、母体血清中代謝産物と同様の変化傾向を示した。
子孫のグルコース代謝における腸内細菌代謝産物の役割
・腸内細菌代謝産物は様々なシグナル伝達経路に影響を与え、宿主の様々な生理的反応に関与する。分岐鎖アミノ酸(BCAA)を含む特定の代謝産物が、インスリン抵抗性リスクと強く関連していることを示唆する研究が増加している。
・ワシントン大学の研究は、子孫の長期的な代謝性疾患の危険因子である妊娠中の母親の体重増加が、子孫の糖質分解およびビタミン合成経路の変化と関連していることを明らかにした。
・動物実験では、母親の糖代謝表現型と腸内細菌叢プロファイルが子孫に「伝達」されることが示されている。この研究では、高血糖ダムを持つマウスの子孫はインスリン抵抗性と耐糖能障害を示している。また、子孫マウスの糞便微生物叢構造は母親のそれと類似。さらに、腸内ビフィズス菌の存在量と糞便中のSCFA濃度が減少していた。腸内細菌叢の垂直的伝播が子孫の代謝に及ぼす影響を調べるため、研究者は帝王切開(CS)を行うことで垂直的伝播を阻止。その結果、膵β細胞分泌機能の低下とインスリン抵抗性がCS群ではGDM発症ダムの子孫において改善されている。糞便中代謝産物レベルもCSの影響を受け、グルコース代謝プロファイルと強い相関が確認されている。
GDMと腸内細菌叢のエピジェネティックな関連と子孫のグルコース代謝への影響
・遺伝子とその転写産物との相互作用を定義するために導入されたのが「エピジェネティクス」という概念である。エピジェネティクスは、高血圧、脂質異常症、T2DMなど幼少期の栄養状態やその後の子孫における糖代謝異常の発症を説明する可能性がある。
近年、腸内細菌叢とエピジェネティック修飾の関係が研究のホットスポットとなっている。
特定の腸内細菌種への曝露によって影響を受けるエピジェネティック修飾の特異的変化パターンは、腸内細菌叢とエピゲノムとの複雑な相互作用の潜在的メカニズムである可能性がある。
・エピジェネティック修飾の要因としての優占微生物叢を探索したある研究では、支配的な腸内細菌門に基づいて、妊婦を高バクテロイデーテス門(HighBact)群とHighFirm群に分類。血液中のDNAメチル化パターン解析の結果、HighBact群の母親はHighFirm群の母親と比較してプロモーターのメチル化が高い遺伝子が568個、低い遺伝子が245個観察された。
同様の現象は臍帯血の分析でも見られ、臍帯血における糖尿病感受性遺伝子UBE2E2とKCNQ1のメチル化は母親の腸内ファーミキューテスの割合と相関していた。
・集団研究から、T2DM患者の腸内バクテロイデーテスとファーミキューテス比率が高いことが糖代謝異常に関与する可能性が明らかになった。Faecalibacterium prausnitziiのようなファーミキューテス門の特定細菌は、ヒストン修飾を通して遺伝子発現を制御することができる酪酸の主要な供給源である。腸内細菌叢がエピジェネティックな修飾を制御する方法は多様で複雑である。
・母親と乳児の栄養とプロバイオティクスに関する研究では、プロバイオティクス補充は37遺伝子プロモーターにおける母親の血中DNAメチル化レベルを有意に減少させ、1つの遺伝子プロモーターにおけるDNAメチル化レベルを増加させることが判明した。プロバイオティクス群の子供たちは68の遺伝子プロモーターが有意に影響を受け、DNAメチル化レベルが低かった。プロバイオティクスを補充した母親とその子供たちは、プロモーターのメチル化が低く、インスリン様成長因子結合タンパク質1(IGFBP1)の転写活性が上昇していた。IGFBP1濃度は糖尿病と関連しており、IGFBP1濃度を増加させることはグルコース代謝に対するプロバイオティクスサプリメントの有益な効果である可能性がある。
子孫の糖代謝における概日リズム-腸内細菌叢相互作用の役割
・糖代謝異常の原因となる生活習慣病危険因子の中で、概日リズム障害はがますます注目されている。概日リズムは人体のほぼすべての細胞に存在する分子生物時計によって駆動されている。
・概日リズムの乱れと代謝の関連はよく知られている。中枢および末梢の概日リズムの乱れにより、動物モデルでは高血糖、脂肪細胞肥大、肥満などのメタボリックシンドロームの特徴が発現している。げっ歯類におけるこれらの代謝異常は、概日リズムが乱れたヒトにおいても高度に一般化される。重要な概日リズム遺伝子であるクリプトクロム2(CRY2)と周期概日調節因子2(PER2)の変異体や多型を持つヒトは高血糖を示す。
・概日リズムが乱れると、妊婦は代謝性疾患リスクが高くなる。
・世代間研究により、GDM女性では子孫の胎児の腹囲zスコアが母親の概日リズムの乱れと関連することが判明している。
・腸内細菌叢にも概日リズムがあり、宿主の概日システムと腸内細菌叢の間には動的な相互作用があることがわかってきている。概日リズムの乱れは腸内細菌叢の構造を変化させ、代謝性疾患への感受性を高める。
炎症と世代間グルコース代謝における腸内細菌叢の役割
・インスリン抵抗性は全タイプの糖尿病の主要な症状で、体内における異常な炎症状態がインスリン抵抗性と密接に関連している。低度の悪性炎症反応は腫瘍壊死因子α(TNF-α)、インターロイキン6(IL-6)、リポカリンなどのサイトカインの増殖につながる。これらのサイトカインは、プロテインキナーゼC(PKC)やmTOR/S6Kなどのシグナル伝達経路を活性化することで全身のインスリン抵抗性を引き起こす可能性がある。
・最近の研究で、腸内細菌叢が異常炎症の発症に関与する重要なリンクである可能性が示唆されている。食事による腸内細菌叢の変化はリポ多糖(LPS)とBCAA吸収とリサイクルを増加させ、SCFAを減少させる。SCFAが減少すると腸管透過性が亢進する一方で、LPSは激しい炎症反応を引き起こす。
・最近の研究で、GDMは腸内細菌叢が誘発する炎症によって引き起こされる可能性が示唆されている。GDM女性は妊娠初期に腸内細菌叢が変化し、炎症性サイトカインレベルが上昇している。
・GDMまたはコントロール群の糞便サンプルを雌マウスに移植したところ、GDM糞便レセプターマウスと非GDM糞便レセプターマウスの微生物叢の違いは妊婦で観察されたものと一致し、さらにGDM糞便レセプターマウスは耐糖能障害の表現型を示した。興味深いことにGDM糞便受容体マウスでは、インターロイキン10(IL-10)とともにIL-6が上昇していた。
・妊娠中の高フルクトース摂取はNF-κB-NLRP3インフラマソーム経路の活性化を通じて、妊娠マウスおよび出生後マウスとその子孫におけるインスリン抵抗性(IR)の発症を促進する。
・GDMマウスのIRに対するプロアントシアニジン(PA)の介入効果を調べた別の研究では、PAがIL-6、TNF-α、IL-17、CRPの発現を減少させ、IRを改善することがわかった。しかし腸内細菌叢欠損(IFD)マウスではIRの改善に対するPAの効果は有意に減弱し、炎症の抑制は阻害された。
腸内細菌叢を標的とした早期介入による子孫のグルコース代謝への影響
GDM治療が子孫の腸内細菌叢とグルコース代謝に及ぼす影響
インスリン
・妊娠時高血糖は周産期合併症や新生児合併症を含む有害な出生転帰の原因となり、成人期の子孫の代謝状態にも影響を及ぼす可能性がある。したがって妊娠中の最適な血糖コントロールを可能な限り短期間で達成することは世代間のグルコース代謝への悪影響を阻止するために不可欠である。
・GDMの第一選択治療は栄養療法と運動の併用である。生活習慣への介入で血糖値をコントロールできない場合は、薬物療法が導入される。
・スペインで行われた対照研究では、食事療法またはインスリン療法でコントロールされているGDM女性において、胎盤の脂質キャリアとインスリンメディエーターに対するインスリンの効果が検討された。結果、インスリン治療を受けているGDM女性において、外因性インスリン治療はインスリンカスケードを活性化することによって胎盤のインスリンメディエーターのリン酸化を促進し、それによって特定の脂肪酸キャリアが上昇し、最終的に胎盤の脂肪酸レベルが上昇することが示された。したがって、血糖コントロールのためにインスリンを使用する場合、胎盤を通して胎児に脂肪が過剰に移行するのを避けるために母体の血中脂質レベルに注意を払う必要がある。
・インスリン治療が子孫の糖代謝に及ぼす影響にも腸内細菌叢は関与している。
妊婦を健常対照群(非GDM群)、食事療法対照群(GDM-D群)、食事療法が無効なインスリン治療群(GDM-I群)に分け、食事療法とインスリン治療がGDM妊婦とその新生児の腸内細菌叢に及ぼす影響を比較した研究では腸内細菌叢の変化が治療前に検出され、GDM-I群ではClostridiales、Lactobacillus、Bacteroidetesの割合が非GDM群およびGDM-D群よりも高いことが示されている。しかしこれらの変化は第2期のインスリン治療により改善され、GDM-I群ではこれら3菌のレベルが有意に低下した。GDM-I群の新生児の糞便中の腸内細菌科細菌は有意に減少していた。興味深いことに、GDM-D群の母親から生まれた新生児はF/B比が上昇しており、これは母親の出産前の状況と一致していた。
腸内細菌叢療法による子孫のグルコース代謝の調節
プレバイオティクス/プロバイオティクスサプリメント
・プロバイオティクスは宿主の腸内細菌システムを安定に維持するのに役立ち、グルコース代謝障害やGDM予防に効果的な介入となりうる。臨床試験では、プロバイオティクス補充がグルコース代謝とインスリン感受性の改善に有益であり、妊婦のグルコース値上昇リスクを低下させて過度の体重増加率を抑制することが示されている。
・GDMの母親が乳酸菌を含むサプリメントを摂取すると、新生児の出生時体重が減少する可能性もある。動物実験では、プロバイオティクス(ラクトバチルス・アシドフィルス、ビフィドバクテリウム・ロンガム、エンテロコッカス・フェカリス)の介入により、妊娠ラットの糖代謝、腸内細菌叢、腸透過性が改善され、子孫の膵島β細胞の分化と発達も改善されている。
さらに、腸内細菌叢組成と活性を調節するプレバイオティクスは、子孫の肝臓のlncRNA Serpina4-ps1/let-7b-5p/Ppargc1a軸を介して糖代謝を改善することも判明した。
・一方でプロバイオティクスは妊娠高血圧症候群リスクを増加させることを指摘するデータも一部あり、プロバイオティクス摂取中は血圧など体調のモニターに注意を払うべきだろう。
母親の食事による子孫のグルコース代謝の制御
微量栄養素の補給
・ミネラル、微量元素、ビタミンなど、母親の微量栄養素欠乏または過剰が子孫のグルコース代謝に及ぼす影響が2004年に調査され、母親に複数のミネラルやビタミン摂取を制限したところ、子孫は早期の成長遅延、高体脂肪率、インスリン抵抗性を示した。近年、微量栄養素の欠乏は母親と子供の健康を脅かす重要な影響因子となっている。
・メタアナリシスの結果、血中25(OH)D濃度の高値はGDM低リスクと関連することが示された。GDMと診断された女性にビタミンDを補充すると、血清空腹時グルコース、インスリン、インスリン抵抗性の恒常性モデル評価(HOMA-IR)濃度が有意に低下している。
・妊娠ラットを推奨ビタミン量(RV)群、高マルチビタミン(HV)群、推奨コリン量を含む高葉酸(HFol)群、コリンを含まない高葉酸(HFol-C)群に分け観察した研究では、HV群とHFol-C群のダムを持つ雄の子供のグルコース負荷に対する反応は、RV群のそれよりも31%高かった。雌の子ではグルコース負荷に対する反応は、RV群よりもHV群およびHFol-C群で29%高かった。
腸内細菌叢組成は、HV群のダムの子孫ではShigella、ClostridialesおよびClostridiaceaeが高く、HFolおよびHFol-C群のダムの子孫ではOdoribacter、Akkermansia muciniphilaおよびBlautiaが高かった。
活性物質の補給
SCFAs
・酢酸、プロピオン酸、酪酸などのSCFAは食物繊維の消化中に腸内細菌叢によって産生される。SCFAは腸管バリアの維持に関与するだけでなく、様々な代謝経路に関与するシグナル伝達分子としても働く。グルコース代謝障害への介入という点では、酪酸の経口投与がマウスモデルでインスリン感受性を増加させることが観察されている。
・世代間モデルにおいて、SCFAの介入が高フルクトース食を与えたダムの子孫の高血圧を改善している。酢酸マグネシウム投与はコントロールと比較して雄の子孫の出生時体重と腎臓重量を減少させ、低栄養のダムでは収縮期血圧と拡張期血圧、平均動脈圧を減少させた。
さらに、酪酸ナトリウム投与はトリプトファンを含まない飼料を与えたダムの子孫の血圧を低下させ、Verrucomicrobiaの存在量を増加させた。
ゲニステイン
・ゲニステインは植物活性物質であり、心血管系疾患、がん、骨ミネラル代謝障害、神経障害を持つ人々に有益な効果をもたらすことが示されている。大豆イソフラボンの重要成分であるゲニステインは糖代謝障害も改善する可能性がある。これはβ細胞の増殖を促進し、インスリン分泌を促進して腸内細菌叢を制御するゲニステインフラボノイドの能力に関連している可能性がある。
・交配3週間前、妊娠中、授乳中のマウスにゲニステインを投与し、その間のグルコース代謝を評価、実験終了時に雄マウスから盲腸内容物、脂肪組織、血液サンプルを採取した研究では、母親のゲニステイン介入により子孫のグルコース代謝が有意に改善され、リケネラ属の存在量が増加し、テネバクテリウム門の存在量が減少したことが観察された。成人期のゲニステイン代謝における腸内細菌叢の保護的役割が確認された。
メチルドナー
・メチルドナーは人体の生化学反応にメチル基を提供する物質群で、葉酸、コリン、ベタイン、ビタミンD、メチオニンなどがある。メチルドナー摂取量は、T2DMを含む様々な疾患と強く関連している。
・子豚モデルでは、母親のメチルドナー補給(葉酸、メチオニン、コリン、ビタミンB6、ビタミンB12)は子豚の腸内細菌叢を変化させ、ファーミキューテス属の存在量を増加させてバクテロイデス属の存在量を減少させる。さらに、21日齢のメチルドナーサプリメント群では糞便中の酢酸、酪酸、および総SCFAs濃度が増加した。
・母親の葉酸やコリンの過剰摂取や不均衡は子孫の肥満リスクの上昇につながり、腸内細菌叢の乱れと関連している。
レスベラトロール
・レスベラトロール(RES)は、主に穀物、野菜、豆類、果物に含まれる天然由来の植物活性物質で抗肥満、抗糖尿病、抗炎症および抗酸化特性を有する。
・ヒトおよび動物実験により、RESは血糖値を下げてインスリン感受性を改善し、乳酸桿菌とビフィズス菌を増加させ、大腸菌と腸内細菌を減少させる。
・高脂肪食(HFD)は子孫におけるファーミキューテス属とプロテオバクテリア比率とラクトバチルス属の存在量を減少させるが、RES補充はこれらの変化を回復させ、HFD誘発性高血圧を予防する。
地中海食
・地中海食(MD)は、飽和脂肪酸が少なくオリーブ油、野菜、果物、穀物、ナッツ類、豆類を多く摂取し、魚、その他の肉類、乳製品を適度に摂取するようにデザインされている。
近年、妊娠中の地中海食が母体と乳児の転帰を改善する効果があることが多くの研究で示されている。
・MDに忠実な妊婦は、子供の肥満や心血管疾患の発症リスクを低減する。母親がMDに忠実でない場合、胎児は新生児インスリン抵抗性と同様に成長制限を経験する可能性がある。
・妊娠中のMDに基づく栄養摂取は妊娠糖尿病発生率を低下させるのに役立ち、GDM妊婦はインスリン療法を必要とする可能性が低く、妊娠中の体重増加が少ない。
・妊娠中のMDは小児喘息、アレルギー、体重増加を予防する。
母親の生活習慣調節が子孫のグルコース代謝に及ぼす影響
身体活動
・妊娠中の適度な身体活動は、一部の妊婦において血糖コントロールの改善に有効だが、身体活動だけではGDMのリスクを減少させるのに十分ではないかもしれない。
スウェーデンの研究では、妊娠前の1年間に運動した健康な妊婦は、妊娠中のみ運動した妊婦に比べてGDMリスクが減少することが示されている。身体活動強度、基礎的健康状態、食事状態の違いも身体活動介入の効果に影響する。
・運動がHFDによって悪化した代謝および腸内細菌叢の機能障害を改善できるかどうかを調べた研究では、HFDを与えた雌ラットは代謝に悪影響を及ぼし、糞便中のファーミキューテス類とバクテロイデーテス類の比率が増加したが、興味深いことに妊娠前と妊娠中の持久系運動のみが腸内細菌叢のこうした変化を防いだ。妊娠中だけ運動した妊娠雌マウスでは、腸内細菌叢の回復は観察されなかった。この現象は、不利な妊娠転帰を改善するには妊娠前の運動が重要であることを強調している。
睡眠
・睡眠はグルコース代謝を調節し、睡眠不足は糖尿病リスクを高める。グルコース調節メカニズムは酸化ストレス、炎症、コルチゾールレベルと関連している可能性が示唆されている。
・妊娠初期における睡眠の質がの低下はGDM発症リスクを高める。睡眠障害もGDMの危険因子であり、大規模集団研究では睡眠障害の女性は対照群よりもGDMリスクが高いことが示されている。
・一方で別のメタ解析では、妊娠初期および中期における過度の睡眠時間もGDMと強く関連していることが示唆されている。
まとめ
妊娠中の高血糖は子孫の代謝の健康に影響を及ぼす可能性が高い。
腸内細菌叢が糖代謝障害に関与していることを示す証拠も増えつつあり、GDM妊婦における腸内細菌叢の変化は子孫における糖代謝異常の危険因子である可能性がある。
胎児の腸内細菌叢の確立は母親からの垂直伝播に依存しており、母親の腸内細菌叢がシフトすると子孫の腸内細菌叢も同じ傾向の変化をたどる可能性がある。
腸内細菌叢産物である子孫の代謝産物も、母親の腸内細菌叢の変化傾向の影響を受ける。
初期のエピジェネティックな修飾はその後の人生における代謝能の重要な決定因子である。