過去の記事で様々な食事性脂肪と健康に関するデータ紹介してきたが、今回の記事は母親の食事性脂質の摂取と子孫の腎臓病及び腎機能に関するデータをまとめてみたい。
近年、母親の疾病、不適切な栄養状態、薬物使用、有害物質への暴露、外因性ストレス、感染が腎臓プログラミングに影響することが報告されている。
腎臓はDOHaDまたは発生プログラミングによって、発生過程において構造的あるいは機能的な変化を呈することがあり、代表的な構造変化はネフロン数の減少である。
胎児期に子宮内で形成されたネフロン数が少ないと糸球体過濾過と糸球体肥大が起こり、結果的に腎機能障害や成人後の腎臓病リスクに直結する。
現在、母体の栄養状態は腎臓病を制御する重要な修正可能因子と認識されている。
飽和脂肪酸の過剰摂取などの高脂肪食が腎臓病発症リスクを高めることがわかっている。
動物実験では、母親の高脂肪食が胎児の組織/器官構造と機能の変化に関連し、後世に様々な成人病(高血圧、脂肪細胞肥大、脂質異常症、肥満、内臓脂肪量増加、肝脂肪症、インスリン抵抗性など)を発症させることがわかっているが、腎臓病は注目されていない。
リンクのレビューは、母親の高脂肪食への曝露が子孫の腎臓の健康および腎臓病に果たす役割について概説したもの。
妊娠中および授乳期の母親の高脂肪食摂取と子孫の腎臓病との関連を示す前臨床研究、腎臓プログラミングの背後にある分子メカニズム、および有害なプログラミング過程を相殺するための早期の介入について要約する。
Maternal High-Fat Diet Controls Offspring Kidney Health and Disease
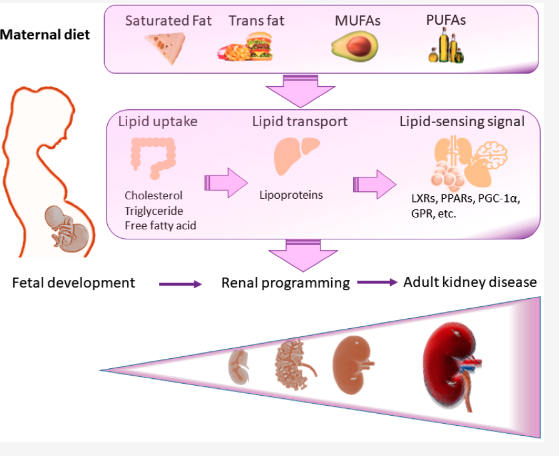
妊娠中の脂肪曝露と腎臓病
食事性脂肪
食事から摂取される脂肪はほとんどが中性脂肪で、食品に含まれる中性脂肪を「脂肪」「油」と呼び、脂肪は脂質のサブクラスであるトリグリセリドグループに属す。
トリグリセリドの構成要素は脂肪酸とグリセロールで、食用脂肪酸は飽和脂肪酸、一価不飽和脂肪酸、多価不飽和脂肪酸、トランス脂肪酸の4種類に分類される。
トランス脂肪酸は人工または天然に由来する不飽和脂肪酸の一種で、反芻動物に由来する天然のトランス脂肪酸は適量であれば安全だが、人工的なものは健康被害をもたらす可能性がある。
一般に飽和脂肪酸とトランス脂肪酸は心血管疾患(CVD)リスク上昇に関連し、一価不飽和脂肪酸と多価不飽和脂肪酸はCVDリスクを減少させるとされている。
脂肪と腎機能
腎臓に存在する脂質にはトリグリセリド、コレステロール、遊離脂肪酸、リン脂質がある。
腎尿細管細胞における脂質代謝は生理的条件下では腎臓を障害から守るが、過剰な脂質蓄積は尿細管細胞で腎機能障害を引き起こす可能性がある。これまでの研究で、慢性腎臓病(CKD)発症リスクはトリグリセリド、LDLコレステロール(LDL-C)、総コレステロールが高値で、HDLコレステロール(HDL-C)が低値の場合に高まることが指摘されている。
また、脂質過多と脂肪酸β酸化(FAO)障害は酸化ストレス、炎症、腎線維化を引き起こす可能性がある。さらに、飽和脂肪酸パルミテートはミトコンドリアストレスと腎臓障害を誘発するが、一価不飽和脂肪酸(MUFA)オレエートはFAOを増加さるため飽和脂肪酸による腎障害に対して保護的である。
腎臓への脂肪蓄積は腎血行動態の悪化、ナトリウム再吸収とレニン分泌の増加、レニン-アンジオテンシン-アルドステロン系(RAAS)の活性化などいくつかの経路で腎臓機能を低下させる。
また、腎周囲脂肪量の増加はヘンレ係蹄と腎髄質を圧迫し尿細管流量の減少につながる可能性がある。
脂肪と胎児の発育
母親の食事は発育中の胎児の腎臓における脂質取り込み、脂質輸送、脂質感知シグナルを変化させ、腎臓プログラミングに変化をもたらす。
母親の高脂肪食が腎臓プログラミングに関与しているという説は、いくつかの証拠によって裏付けられている。まず、高脂肪摂取による腎障害は腎臓のPax2発現減少に関連している。ネフロン数の減少に関連する腎形成遺伝子はPPAR標的遺伝子(例えば、Pax2)。さらに、PPARγはNos2、Nos3、Sod2、Nrf2などの酸化ストレスに関与する膨大な数の遺伝子を直接制御する。
いくつかのPPAR標的遺伝子はレニン・アンジオテンシン・アルデステロン系(RAAS)構成要素やナトリウムトランスポーターである。
遊離脂肪酸はGタンパク質共役型受容体(GPR)のリガンドで、遊離脂肪酸受容体(FFAR)とも呼ばれる。短鎖脂肪酸(SCFA)は腸内細菌による食物繊維の発酵によって生成され、主に酢酸、酪酸、プロピオン酸を含む。SCFAはGPR41とGPR43を活性化し、長鎖脂肪酸はGPR40とGPR120を活性化する。SCFAとその受容体は母体の代謝と胎児プログラミングに重要な役割を担っている。
過去の研究では、妊娠中および授乳期に栄養不良に曝露された子孫の腎臓構造の変化(ネフロン数の減少)が報告されている。
発育中の腎臓におけるいくつかの分子経路(例えばPPAR)の異常な遺伝子発現は、ネフロン欠損、RAAS調節不全、ナトリウム輸送体の増加および血圧上昇に寄与すると考えられる。
腎臓プログラミングの根底にあるこれらのメカニズムはすべて子孫の将来の腎機能に悪影響を及ぼす。
腎臓プログラミング
脂肪の種類ごとの影響 (動物モデル)
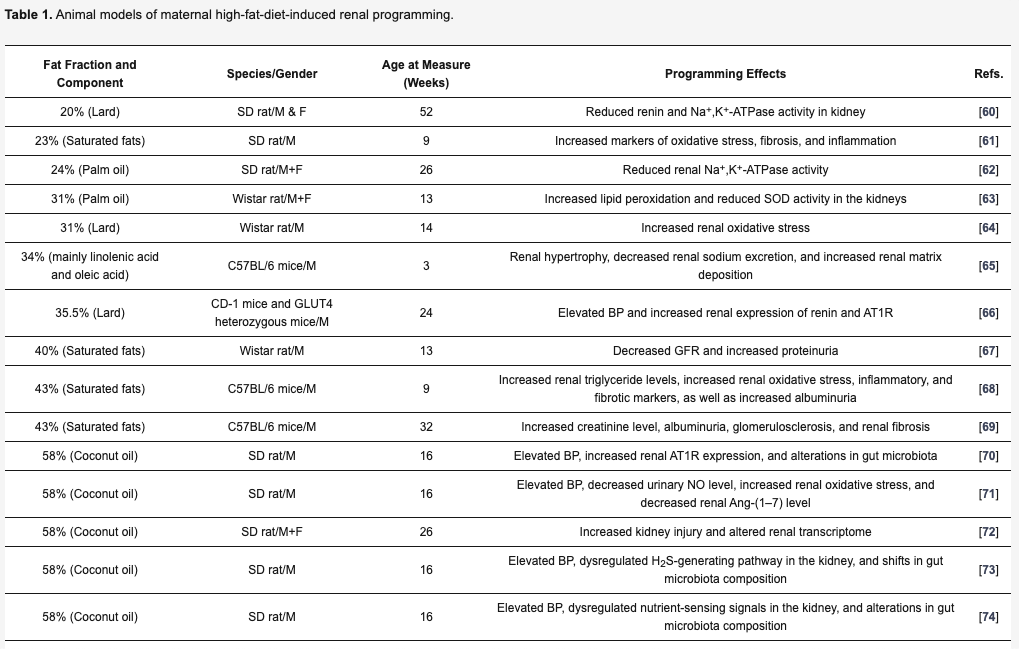
ラード(SD rat):腎臓のレニンおよびNa+,K+-ATPase活性の低下
ラード( Wistar rat):腎臓における酸化ストレスの増加
ラード(CD-1マウスおよびGLUT4ヘテロ接合体マウス):血圧上昇および腎臓のレニンおよびAT1R発現量増加
飽和脂肪酸(Wistar rat):GFRの低下と蛋白尿の増加
飽和脂肪酸(SD rat):酸化ストレス、線維化、炎症マーカーの増加
飽和脂肪酸( C57BL/6 mice):腎臓トリグリセリド値の上昇、腎臓の酸化ストレス、炎症、線維化マーカーの上昇、アルブミン尿の上昇。
パーム油(SD rat):腎臓Na+,K+-ATPase活性の低下
パーム油(Wistar rat): 腎臓における過酸化脂質の増加、SOD活性の低下
リノレン酸、オレイン酸(C57BL/6 mice):腎肥大、腎ナトリウム排泄量低下、腎マトリックス沈着量増加
ココナッツオイル(SDラット): 血圧上昇、腎臓AT1R発現量増加、腸内細菌叢変化
ココナッツオイル(SDラット9:血圧上昇、尿中NO濃度低下、腎酸化ストレス増加、腎Ang-(1-7)濃度低下
ココナッツオイル(SDラット): 腎障害の増加および腎臓トランスクリプトーム変化
ココナッツオイル(SDラット): 血圧上昇、腎臓のH2S生成経路の制御異常、腸内細菌叢組成の変化
ココナッツオイル( SDラット): 血圧上昇、腎臓の栄養感知シグナルの調節障害、腸内細菌叢の組成変化
ココナッツオイル(SDラット):血圧上昇、腎臓の栄養感知経路の障害
DOHaD
生涯にわたる健康は幼児期/発育期や生涯にわたって経験する一連の「ヒット」によって悪影響を受ける可能性が様々な研究で報告されている。
「ファーストヒット」は母親が経験する有害因子で、子孫を成人病にかかりやすくする。
出生後の有害因子は「セカンドヒット」と呼ばれ、出生前の脆弱性が引き金となり悪化する。
ある研究では母親の高脂肪食がファーストヒットとして適用され、その後の人生で腎臓病を誘発するセカンドヒットが観察されている。例えば動物モデルでは、出生後の高脂肪食や母体の高脂肪食、高ショ糖食、高塩分食を組み合わせが腎臓プログラミングの研究で使用されている。様々な種類の高脂肪食を用いた動物モデルでは、母親への高脂肪食が子孫の腎臓にプログラミング効果をもたらすという仮説を支持している。
さらに、別のヒットにより同じプログラミングメカニズムが引き起こされ、有害作用が増幅され、最終的に疾患状態に至ることも観察されている。
母親の高脂肪食と腎臓プログラミングの関連メカニズム
現在、いくつかのメカニズムが腎臓プログラミングと結びついていることが報告されている。
中でも、酸化ストレス、一酸化窒素(NO)欠乏、RAAS異常活性、栄養感知シグナルの乱れ、腸内細菌叢異常、炎症、硫化水素(H2S)シグナル調節異常は、母親の高脂肪食曝露と相互に関連している。
酸化ストレス
酸化ストレスは、プロ酸化力と抗酸化力の間の不均衡で腎臓プログラミングに関与している。
妊娠期間中、発育中の腎臓は胎児の抗酸化能不足により活性酸素種(ROS)の過剰産生に対して脆弱な状態にある。
様々な動物モデルでは、母体からの様々な刺激が酸化ストレス関連の腎臓プログラミングを誘発することが示唆されている。この関連性は活性酸素の産生増加、抗酸化能低下、脂質過酸化の増加および酸化的損傷の増加というメカニズムで説明できる。
一方で、天然および合成抗酸化剤は腎臓疾患のリプログラミング療法として機能する。
様々な抗酸化物質が酸化ストレスを軽減し、腎臓病を予防する潜在的な役割を示す。
一酸化窒素(NO)欠乏
NOは腎臓で生理的およびシグナル伝達機能を担っており、NO欠乏は腎臓病の病因に関与する。妊娠中もNOは胎盤循環の調節と胎児の発育に重要な役割を担っている。
非対称ジメチルアルギニン(ADMA)はNO合成酵素の内因性阻害剤であり、L-アルギニンと競合してNO産生を減少させる。ADMAは培養ラット胚腎においてネフロン欠損を引き起こし、腎臓トランスクリプトームを変化させる。
腎臓におけるNO欠乏は母親の高脂肪食による腎臓プログラミングに関連する。
妊娠中および授乳期の高脂肪摂取は、血漿中L-アルギニン濃度およびNOバイオアベイラビリティの指標であるL-アルギニン-ADMA比の減少をもたらす。
ある研究では、母親のビスフェノールA曝露(BPA)が成人男性子孫の母親の高脂肪食誘発性高血圧を悪化させ、ADMA濃度上昇とL-アルギニン-ADMA比の低下と関連していることが示されている。さらに、母親の高脂肪食とBPA曝露が相乗的に子孫の腎臓に酸化的障害を誘導することがわかった。
一方で、ポリフェノール系抗酸化物質であるレスベラトロールは母体の高脂肪食とBPAによる高血圧および酸化的損傷から成体子孫を保護した。
レスベラトロールの保護作用はNOバイオアベイラビリティの回復に関連している。
また母親のN-アセチルシステインによる抗酸化療法は、成人子孫の高血圧と酸化的損傷を防ぐ。
RAAS異常
RAAS系は血圧と腎臓を制御する重要なホルモンカスケードで古典系と非古典系という2つの経路がある。
高脂肪摂取による古典的RAASの活性化は、血管収縮、酸化ストレス、炎症を引き起こし、結果として腎臓病を引き起こす。母親が高脂肪食を摂取した子孫の高血圧は、AT1Rの腎タンパク質レベル、AgtとAceのmRNA発現の増加によって表される古典的RAAS異常活性化と一致する。
多くの研究がACE2-アンジオテンシン(1-7)-Mas軸が保護的な役割を持つことを報告している。新しいエビデンスは、新生児期には古典的なRAASシステムのダウンレギュレーションによる一時的な二相性反応があるが、加齢とともに正常に戻るという仮説を支持している。
母親の高脂肪食は成体におけるこの正常化を阻害する可能性があり、その後古典的RAAS系は異常活性化を示し、非古典的RAAS軸はダウンレギュレートする。
栄養感知シグナルの乱れ
食事性脂肪は、脂質の検出、満腹信号、食物摂取および体重増加に関与する栄養感知シグナルを調節することが証明されている。これらの栄養感知シグナルにはAMP活性化プロテインキナーゼ(AMPK)、サーチュイン-1(SIRT1)、PPAR、PPARγ coactivator-1α(PGC-1α)がある。
妊娠中、母親の食事は栄養感知シグナルを介して胎児の代謝と発達を制御する。したがって、妊娠中の不均衡な食事は栄養感知シグナルを乱し、成長後の成人病に決定的な影響を与える可能性がある。
母親の高脂肪食による高血圧は、子孫の腎臓におけるAMPK/SIRT1/PGC-1α経路の阻害と関連している。AMPKはPGC-1αをリン酸化し、その下流のPPARγシグナルを制御する。先行研究では、PPAR標的遺伝子の特定のセットが腎臓のプログラミングに関与していることが示されている。
腸内細菌叢異常
腸内細菌叢の形成と増殖は出生時に始まり、腸内細菌叢組成の変化は栄養と環境要因に依存する。したがって母親の食事は子孫の腸内細菌叢組成に重要な役割を果たす。
現在のエビデンスでは、高濃度飽和脂肪酸は腸内細菌の豊かさと多様性を低下させることが示唆されている。
動物実験では、脂肪分の多い餌を与えたダムを持つ成体ラットの子孫で腸内細菌叢α多様性の低下が認められた。また、母親の高脂肪食が子孫に高血圧を誘発することは、高血圧の微生物マーカーとされるFirmicutes/Bacteroidetes(F/B)比の上昇と関連していることが分かった。
さらに、母親の高脂肪食モデルではLactobacillusやAkkermansiaなどの有益微生物の減少が見られた。
トリプトファン由来代謝物、SCFA、トリメチルアミン(TMA)、トリメチルアミンN-オキシド(TMAO)などの微生物代謝物は腎プログラミングに関与している。ある研究では、母親が高脂肪食に暴露すると3週齢ラット子孫において、SCFAであるプロピオン酸の糞便濃度が低下することが示された。逆に周産期のプロピオン酸の補給は、慢性腎臓病(CKD)の母ラットから生まれた成体の子孫を高血圧から守ることが示された。
リプログラミング
リプログラミング介入
母体の高脂肪食による腎臓プログラミングの背後にあるメカニズムを標的とした戦略開発が進むにつれ、リプログラミングの可能性が見えつつある。
腎臓病発症を制御するメカニズムを相殺するこれまでのリプログラミング介入は、危険因子の回避、ライフスタイルの改善、栄養補給、薬物療法。
飽和脂肪酸を多く含む母親の食事は悪影響を及ぼすため、妊娠中や授乳期に飽和脂肪酸の過剰摂取を避け、子孫の腎臓病を回避するための普遍的なアプローチが必要と考えられる。
一方で、妊娠中および授乳中の食事性不飽和脂肪酸の摂取は、子孫の腎臓の健康に有益な影響を与える可能性がある。妊娠と授乳期の最後の週にPUFAを豊富に含む食事を与えた研究では16週齢の雄子孫の高血圧発症が抑制されている。
別の研究では、周産期のオメガ3PUFA補給が、母親の高脂肪食誘発性腎臓損傷と女性成人子孫の腎臓プログラミングを減弱させることが報告された。同様に、オメガ6系PUFAであるリノール酸を妊娠中および授乳中に補充することで、母親の高脂肪食によってプログラムされた子孫の高血圧を回避することが観察されている。
他にも、Limosilactobacillus fermentum、ヒドラジン、長鎖イヌリン、Lactobacillus casei、レスベラトロール、ガーリックオイル、AMPK活性化物質の初期介入が、母親の高脂肪食誘発性腎臓プログラミングを防ぐリプログラミングのアプローチとして利用されている。
腸内細菌叢が、母親の高脂肪食誘発性腎臓プログラミングを改善するためのリプログラミング介入のターゲットであることは重要。
プロバイオティクスとプレバイオティクスは頻繁に研究されており、両者とも人間の健康や腎臓病の治療に役立つことが長い間認識されている。
妊娠中および授乳期にLactobacillus caseiとLimosilactobacillus fermentumを投与すると、母親の高脂肪摂取によってプログラムされた子孫の高血圧が回避されることがわかっている。
さらに、長鎖イヌリンによるプレバイオティクス処理は母親の高脂肪食誘発性腎臓プログラミングから子孫を保護し、有益な微生物ラクトバチルス種の存在量の増加、糞便SCAF濃度の増加、血漿TMAOレベルの減少に関連する。
別の研究では、天然プレバイオティクスであるニンニクが母親の高脂肪食誘発性の子孫の高血圧に対する保護効果をもたらし、それに伴ってα-多様性と有益な細菌であるラクトバチルスとビフィドバクテリウムの存在量、血漿SCFA濃度が増加することが明らかになっている。
レスベラトロールはSIRT1/AMPK/PGC1-α経路を回復させることで、母親の高脂肪食負荷による高血圧を回避するのに利用される。
まとめ
母親が飽和脂肪酸を多く含む食事を摂取すると、腎機能障害、タンパク尿、尿細管機能障害、腎肥大、腎線維症、高血圧などの成人子孫の腎臓プログラミングに関連することが示された。
しかし周産期のPUFA補給により子孫の腎臓の健康状態を改善することができる。
妊娠中および授乳中のバランスの取れた食事は、その後の子孫の腎臓病に対する感受性を決定する上で重要である。
現在のところ妊婦の高脂肪摂取と子孫の腎臓病とを関連付ける直接的な証拠はまだ限られているが、動物モデルでの研究は、母親の高脂肪食が腎臓プログラミングを促進する分子メカニズムについて重要な洞察を与えてくれるだろう。