世界共通の疾病として癌、高血圧、2型糖尿病(T2D)などの慢性疾患が挙げられるが、肥満はこれらの病態の病態生理学的メカニズムの初動であることが多い。
WHOによって成人BMI30.0kg/m2以上、またはウエスト-ヒップ比が男性で0.90以上、女性で0.85以上は肥満と定義されている。ちなみに、BMIが18.5kg/m2未満を低体重、25.0~29.9kg/m2を過体重と定義している。
肥満の病因は多因子だが、近年研究されている最も興味深い要因の1つに腸内細菌叢の影響がある。
腸内細菌叢の構成、多様性指数、相対レベル、機能的経路など、腸内細菌叢の問題は成人肥満の素因になる可能性が示唆されている。
”マイクロバイオータ”は特定の生息環境における微生物、”マイクロバイオーム”はその環境における微生物の総体として定義される。
マイクロバイオータとBMIの関連についての仮説の1つに、特定の細菌群が栄養素やエネルギーを効率よく吸収し、栄養素の急速な代謝によって吸収カロリーを高め、BMIの上昇につながるというものがあるが、研究結果は一致していない。
また、腸内細菌が肥満に関与する機序として、食欲不振を引き起こす腸管GLP-1や、特に腸内細菌が介在する胆汁酸(BA)シグナルの調節異常が提案されている。
リンクのレビューは、腸内細菌叢と肥満を関連を解明することを目的としたもの。
Gut microbiota and obesity: New insights
・肥満における微生物叢の変化
いくつかの研究で、肥満者では正常体重の人と比べて細菌数に差があることが観察されている。腸内細菌叢の90%はFirmicutesとBacteroidesで構成されているが、これらの細菌の相対的な存在量とその因果関係については論争がある。
・微生物叢と肥満、そして年齢
過体重や肥満状態は妊娠性肥満を含め若年層で最も多く観察され、腸内細菌叢の構成と関連している可能性がある。
妊娠性肥満は腸内細菌叢を変化させ、妊娠第3期にはバクテロイデスの濃度が上昇する。
この状態では、児の腸内微生物組成の変化により新生児肥満のリスクが倍増する(935組の母子コホート研究において、肥満の母親の新生児の7.5%が1歳および3歳の時点で肥満を呈した。肥満の子供たちはFirmicutes存在量が増加していた)。
明確に定義されていないが、微生物叢は生後1年間に増加し、年齢とともに変化することが知られている。
12人の双子を対象に微生物叢の構成を測定した研究では、正常体重児および肥満児ともに生後1カ月ではVeillonella、Klebsiella Akkermansia、Streptococcus、Staphylococcusが優勢であるのに対し、6カ月ではBifidobacteria、Lachnospiracea incertae sedis、 Escherichia、Shigellaが優勢で、細菌種の多様性や豊富さには大きな違いがないことが確認された。
また、96名の女子(14-19歳)を体脂肪率(BF)が十分な富栄養型、高富栄養型、高肥満型の3グループに分けて微生物組成を測定したところ、高肥満型グループは他のグループに対してFirmicutesが優位だったが統計的有意差はなかった。
・微生物叢と肥満、そして体重
微生物叢と体重コントロールの関係には特に因果関係はなく、肥満の有無によって菌種構成が異なると考えられている。
イランの研究では、正常体重者50名と肥満者50名の腸内細菌組成が比較され、肥満者ではFirmicutes/Bacteroides(F/B)比が増加することが示されている。
ウクライナの成人61名でも同様の関係が認められ、BMI値が高くなるにつれてF/B比が増加することがわかった。
中国の3歳から18歳の小児集団においても、肥満者は非肥満者に比べてF/Bの相対存在量が有意に高いことが確認された。
一方で、正常体重の被験者と肥満の被験者の間で種の多様性に有意差は認められなかったとする研究もあり見解は一致しない。
・腸内細菌叢と胆汁酸(BA)
腸内細菌は胆汁酸の代謝に関与している。
コラート(cholate)はデオキシコラート(deoxycholate)に、チェノデオキシコラート(chenodeoxycholate)はリトコール(LCA)に変換される。この作用は、主にFirmicutesとBacteroidetes系統、特にClostridium属に存在する胆汁酸ヒドロラーゼ酵素による。
BAはGLP-1の産生を増加させてGタンパク質共役型細胞膜胆汁酸受容体(TGR5)を活性化する。このホルモンはグルコースのホメオスタシス、エネルギー代謝、BA合成、抱合および輸送を調節する。微生物叢の酵素作用が変化するとBA組成も変化し、脂肪の吸収が促進されて肥満が引き起こされる。
これは、高BMIの被験者183人(代謝的に健康な121人、代謝的に不健康な62人)を評価した最近の研究で裏付けられている。不健康な肥満の被験者は、一次BAと比較して二次BAの割合が有意に低かった。 BA組成の変化が肥満の代謝状態に関与している可能性を示唆している。
・微生物叢、肥満、運動
微生物叢は運動によって変化し、代謝プロファイルや免疫反応を改善する。
その効果は動物やヒトの研究ですでに実証されているが、標準体重の人と肥満の人とでは異なる。
32人の被験者(痩せ型18人、肥満型14人)を対象にした研究で、運動後の微生物叢組成は肥満型でBacteroidesが優勢で、正常体重者でFaecalibacteriumとLachnospiraが優勢となり、細菌属に変動がみられた。
また微生物叢の構成が運動前と異なり、これらの変化は運動停止後に寛解することが示された。
同様の結果は、27人の座りがちなライフスタイルの肥満者にも見られ、中程度の運動と激しい運動の後ではBacteroidesが増加し、BlautiaとClostridiumが減少してF/B比が低下した。
また、BMI20-25Kg/m2の閉経前女性40人(活動的な19人と座りがちな21人)を対象とした研究では、両群間でαおよびβ多様性やFirmicutes/Bacteroidetes関係に有意差は検出されなかったが、活動的な女性ではFirmicutesが多く、Bacteroidetesが少なかった。
・微生物叢と肥満に関連する病態
肥満は様々な組織で低レベルの慢性炎症を引き起こし、耐糖能異常、インスリン抵抗性、心血管疾患などの代謝異常と関連する。
腸内細菌叢は短鎖脂肪酸やBAなど様々な代謝産物を産生し、糖代謝や宿主ホルモン調節に影響を与える。
高脂肪食によって肥満を誘発された被験者では、細菌性リポ多糖(LPS)濃度の上昇が確認されている。腸内細菌叢はLPSを放出するが腸内細菌叢の変化はその移行を促進し、代謝性エンドトキシン血症やインスリン障害を引き起こす可能性があると考えられる。細菌性LPSとインスリン抵抗性の関連は、gnotobioticマウスで報告され、腸内細菌の存在は白色脂肪組織におけるグルコース代謝障害、炎症性M1表現型へのマクロファージの蓄積と極性の上昇、その結果、インスリン抵抗性の発症を引き起こすことが明らかにされた。
肥満の小児21人を対象とした研究では、異なるインスリン抵抗性プロファイル間で細菌フィラの存在量に有意差は認められなかったが、インスリン抵抗性が高い小児ではマイクロバイオームの多様性が低いことが示された。マイクロバイオームの多様性低下は、インスリン抵抗性の高い肥満児においてより顕著だった。
正常体重の成人、過体重の成人、および肥満の人を対象とした研究では、若い被験者は炎症が少なく、総脂肪率および内臓脂肪率が低く、心血管リスクとインスリン抵抗性に関連する指標のレベルが低いことが明らかになった。この研究では、炎症スコアが高い被験者は微生物叢の多様性の低下とプレボテラ科、Veillonella属が関連しており、対照的にコリオバクテラ科は炎症性表現型に対して保護効果を発揮するようだった。
いくつかの特定の細菌種は肥満の文脈でインスリン抵抗性の低レベルと関連している。
肥満および痩せたアジア人において、Akkermansia muciniphilaの腸内存在量とインスリン抵抗性の重症化リスクとの間に負の相関関係が観察されている。
・微生物叢、体重減少、代謝の変化
微生物叢の生存は、食事構成、ライフスタイル、プレバイオティクス、プロバイオティクス、抗生物質の使用によって変化する。
ディスバイオーシスは、T2D、非アルコール性脂肪肝疾患(NAFLD)、心血管疾患(CVD)、がん、肥満の結果であると提唱されている。
ディスバイオーシスはグラム陰性菌の外膜の内毒性分子であるLPSの放出を増加させ、免疫と腸管粘膜バリアを変化させ、「リーキーガット」と炎症経路の活性化を引き起こす。
プレバイオティクスは難消化性食物繊維で、腸内細菌叢によって発酵する。
最も研究されているのはフルクタンとアラビノキシラン(食物繊維)で、腸内細菌叢はこれらを短鎖脂肪酸(SCFA:酢酸、プロピオン酸、酪酸)などに変換する。
プロバイオティクスの多くは微生物群に類似した機能を持つ種に属している。
プロバイオティクスは、肝レベルで「ペルオキシソーム増殖剤活性化受容体-y(PPAR-y)」の発現を負に制御することに加え、胆汁酸塩の加水分解、脂肪蓄積の減少、全身性炎症およびレプチン値の減少能力を示している。
プレバイオティクスについても、同様の論争が研究により示されている。
韓国の肥満者を対象に、Lactobacillus plantarum K50(LPK)を12週間補給したところ、L. plantarumの増加およびActinobacteriaの減少とともに総コレステロールおよびトリグリセリド値が有意に減少し、いずれも内臓脂肪率の変化と相関していた。
閉経後女性に複数種のプロバイオティクス介入を施したところ、微生物叢の多様性と分類学的構成に影響を与えることなく、生化学的、生理的、免疫学的パラメータへの影響が変化したことも報告されている。
最近の研究では、シンバイオティクスサプリメントによる経時的な血糖値の低下と乳酸菌量の増加との間に関連性があることが判明している。
タイで行われた2つの無作為化臨床試験では、腸内細菌叢と身体測定および代謝パラメーターとの関連性が報告されている。
最初の試験では、18~65歳のアジアタイの肥満成人(BMI≥25kg/m2)を対象に、共生菌サプリメント群とプラセボ群を投与、比較した。
12週間のサプリメント摂取後、シンバイオティクスグループでは体重、BMI、体脂肪、ウエスト周囲径、ウエスト/ヒップ比、HDL-C、LDL-C、IL-6、IL-10、IL-1β、TNF-α、IgA、LPS、ゾヌリンの値にベースライン値との有意差が認められた一方、プラセボグループでは有意差は得られなかった。
2つ目の研究では、高齢者を対象にプロバイオティクスを投与。
腸管バリア機能の改善(最大48%)、高密度リポタンパク質コレステロール(HDL-C)の有意な増加、肥満関連の身体測定バイオマーカーの改善、ヒト被験者の短鎖脂肪酸レベルの改善などが達成された。
体脂肪調節に対する臨床効果は、プロバイオティクスを投与した場合により顕著に現れるようだ。
過体重および肥満の成人患者において、プロバイオティクス(B420)とプレバイオティクス(精製ウルトラポリデキストロースまたはLU)を組み合わせた介入を行った研究では、B420、LU投与群は全グループで腸内細菌叢がプラセボと比較して修正されたことが実証されている。6ヶ月間の介入でB420を投与された患者群はプラセボと比較してAkkermansiaおよびStreptococcusの存在比が高いことが示された。
B420+LUによる介入では、Akkermansia、Christensenellaceae、Methanobrevibacterの存在量が増加し、Paraprevotellaの減少がみられた。Paraprevotellaは脂肪体量と正の相関があり、その存在量増加は代謝にとって有害である可能性が示唆された。
さらに、Family Christensenellaceaeは、ウエスト・ヒップ指数、エネルギー消費量、股関節体脂肪量と負の相関があることが示された。
・肥満手術
肥満手術はカロリー摂取量の減少または吸収不良、グルコース代謝の改善をもたらし、腸内細菌叢に変化を生じさせる。
肥満手術を受けた患者の微生物叢の変化と臨床マーカーとの間に有意な関連があることが示されている。ビリルビンの増加はPrevotellaceae, Bacteroidales, Peptococcaceae属の増加と関連し、鉄分の増加はPasteurellaceaeの増加と関連、HbA1cの減少はCoriobacteriaceaの減少およびClostridialesの増加と関連している。
コレステロール値の低下に関しては、LachnospiraceaceaeとCoriobacteriaceaeの間で最も顕著な正の相関が観察されている。
術後に持続する微生物叢の変化は、解剖学的および生理学的適応、ならびに酸産生の減少、酸素濃度の上昇、胆汁酸の濃度変化を示唆している。
クラッシュダイエットの影響下ではBifidobacteriaceaeが増加してStreptococcaceaeが減少し、手術の影響ではStreptococcaceaeが増加しBifidobacteriaceaeが減少することが示された。
クラッシュダイエットは微生物叢の多様性と組成の変化を引き起こすが、外科的処置(RYBG、SG)は、体重減少に寄与する微生物多様性の組成と回復の初期変化を防止すると思われる。RYGBの結果生じるpHの上昇は、プロバイオティクス細菌の生存を確実にすることが示されており、外科手術患者はプロバイオティクス療法の治療ターゲットとなる。
外科的処置を受けている患者は、体重減少を妨げ、腸内細菌叢の構成と組成に障害と影響を与えると思われる微量栄養素(ビタミンと必須元素)欠乏のリスクを増加させる小腸細菌の過繁殖を起こす可能性があることから、手術後には微生物バランスを修正し、微生物-宿主間の相互作用を改善するための具体的な介入が必要。
これらの戦略の1つは、減量、小腸内細菌過剰増殖(SIBO)の減少、微量栄養素の合成の改善、代謝状態の最適化に貢献するプロバイオティクス療法である。
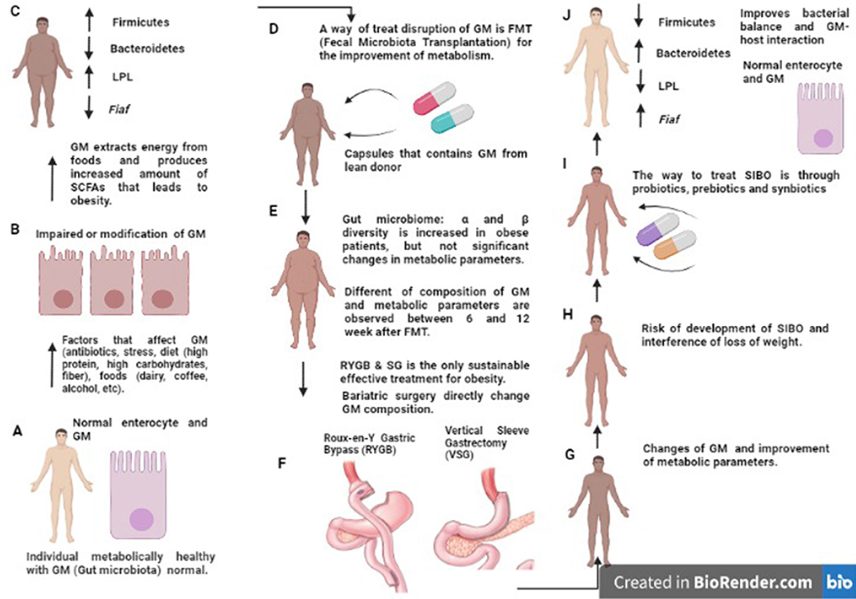
Roux-en-Y Gastric Bypass(RYGB)手術は、T2D患者において血糖値を長期に渡って改善させる効果がある。肥満の1型および2型糖尿病(T1D、T2D)患者が肥満外科手術を受けると、「正常」なマイクロバイオームの患者と比較してマイクロバイオームの構成が大きく異なり、減量すればするほど一般に患者さんの代謝状態が大きく改善する(BMI、グルコース、HbA1c、トリグリセリドなど)。
一方で手術には吐き気、嘔吐、感染症、栄養不足による神経障害、摂食障害(うつ病、不安症)などの副作用もある。
・制限食
代謝異常のある患者や健康な成人に推奨される適切なカロリー制限(CR)は代謝異常の発生を遅らせることができ、微生物叢の組成および代謝機能の変化と関連する。
過体重および肥満女性を対象とした研究では、800KcalのCRによる介入によって、体重、脂肪率、高血糖の低減、微生物の多様性および体重減少に有効なSCFAsの豊富さが低減することが報告されている。CR後の微生物叢(post-CR)は、食事からのエネルギー抽出能力が低いことが特徴的だった。
結論
腸内細菌叢と肥満のメカニズムと関連づける集中的な研究によって、GLP-1産生の増加、より効率的なグルコースホメオスタシス、インスリン抵抗性の低下、脂肪吸収の減少、体重増加のリスクをもたらすBA代謝への関与が明らかになった。
腸内細菌が体重管理に影響を与えるもう一つの方法は、免疫機能関連の代謝プロセスの変化。主に、高脂肪食によって誘発された肥満の被験者に見られる細菌LPSレベルの上昇に起因するものだった。それらの変化はLPSに依存しないにもかかわらず、粘膜の免疫反応を引き起こし、腸管透過性の上昇を引き起こす可能性が観察された。高血糖は腸管透過性を増加させ、LPSの全身循環への移行を引き起こし、肝および脂肪組織の慢性炎症、グルコース障害またはインスリン抵抗性の発症、さらにはメタボリックシンドロームの発症に関与している可能性がある。
身体活動が腸内細菌に与える影響について研究では、運動は少なくとも一時的に、代謝プロファイルと免疫反応を改善し、バクテロイデスの割合を増加させることが観察された。
多くの研究が肥満患者の腸ではファーミキューテス/バクテロイデスの比率が高いことを示しているにもかかわらず、この比率が逆であるか関連性がないことを指摘した研究もあり結論は一致しない。
多くの研究で、プレバイオティクスやプロバイオティクスを個別に投与するよりも、シンバイオティクスを使用する方がより大きな効果があることが分かっている。