まとめていて久しぶりに興奮。
このところ腸内細菌叢のデータをまとめるなかで、おそらく関節痛においても腸内細菌叢が一定の役割を果たしているだろうと自分の中で立てていた仮説があったのだが、先日それを裏付けるレビューがついに出た。
過去のヘルニア患者さんや腰痛患者さんの治療で集めたデータともリンクする部分が多く、おかげで鮮明な形で頭の中で整理することができた。
世界的に腰痛(LBP)は筋骨格系障害の主要原因で、何百万人もの人々のQOLに影響を及ぼしている。
当院でも腰痛のご相談が無い日はほとんどないと言っても過言ではない。
腰痛の原因には構造的ストレス、加齢、遺伝的要因など多くの可能性があるが、椎間板(IVD)変性症(IDD)も可能性の高い原因のひとつ。
しかし、IDVが変性に至る機序や炎症の正確な原因や性質が明確になっていない。
炎症の引き金のひとつとして、皮膚細菌、特にプロピオニバクテリウム・アクネスがIVDに感染することによると考えられている。
現在、様々な研究によって、消化器系、皮膚、口腔内のマイクロバイオーム(人体に存在する微生物)組成の変化は、関節リウマチ、変形性関節症、強直性脊椎炎、敗血症性関節炎、その他の感染症など多くの疾患における炎症と自己免疫制御と関連することが明らかになっている。
現在、微生物の変化がIDDに何らかの役割を果たしているかどうかはまだわかっていが、既存のエビデンスはマイクロバイオーム組成および関連代謝産物の変化が、IDD患者におけるLBPに重大な関与を果たす可能性を強く示唆している。
リンクのレビューは、マイクロバイオーム異常症がIDDおよびLBPに及ぼす影響の可能性について議論している。
結果
マイクロバイオーム組成の変化やマイクロバイオータに対する宿主の応答が、病的な骨の発生や退縮を引き起こすことから、腸-骨髄軸や腸-骨軸という概念が生まれた。
IDDやLBPにおけるマイクロバイオームの役割を説明するために、腸-椎間板軸という概念も提唱された。
既存のエビデンスによると、マイクロバイオームはIVDの外部および内部の微小環境を変化させたり調節したりすることで、IDDを誘発・悪化させる重要な因子である可能性が指摘されている。
腸内細菌叢がIVDを誘発し、LBPを引き起こすメカニズムとして考えられるのは、
(1)腸管上皮のバリアを越えてIVDに移行する
(2)粘膜および全身性免疫系の調節
(3)腸管上皮での栄養吸収および代謝物形成とIVDへの拡散の調節
腸内細菌と体内の他の細菌をターゲットにすることで、体内の炎症を抑制し、カスケード反応の増幅を阻止することはIDDとLBPの治療にとって価値があると考えられると結論。
Gut-disc axis: A cause of intervertebral disc degeneration and low back pain?
・ヒトマイクロバイオームとIDD
24の腰部IVDを評価した結果、健康なIVDのマイクロバイオームの構成が変性IVDやヘルニアIVDのそれと異なることを報告した研究では、正常なIVDサンプルにはファーミキューテス、アクチノバクテリア、サッカロポリスポラが豊富に存在し、これらの菌は腸管バリア機能や抗菌作用に関係していることが判明した。
一方、椎間板炎、骨折、関節感染、髄膜炎、心内膜炎に関与するとされる変性・ヘルニアIVDでは、バチルス・コアグランスやバチルス・クラウジイなどヒトに共通する病原体がわずかに検出されている。
変性した骨盤では、シュードモナス・ベロニイ、シュードモナス・スタッツェリ、ストレプトコッカス・アンギノサスなどの「悪玉菌」が多く見られ、不顕性感染や炎症反応を引き起こし、骨盤変性を誘発する可能性があることが明らかになった。
善玉菌と悪玉菌のバランスが崩れるディスバイオーシスは、食事、病気、宿主の遺伝子構成、医療介入など、様々な環境要因に影響で細菌叢の数が調節され、腸内微生物の多様性が乱されることで起こる。
「善玉菌」が体内組織を保護し、「悪玉菌」が体内組織を損傷するメカニズムはまだ解明されておらず、さらなる研究が必要。
本研究は、IVDの無菌性に関連するドグマを覆す。
IVDと腸の間に58、IVDと皮膚の間に29の重複する細菌種が存在することから、IVDマイクロバイオームが腸内マイクロバイオームとCross Talkし、腸内マイクロバイオームがIVD環境に浸潤して、IDDの発症に重要な役割を果たす可能性があることが示唆された。
この点で、プロピオニバクテリウム・アクネスは最も頻繁に分離される嫌気性細菌で、骨・関節感染症における椎骨骨髄炎と大きな関連性を持つことが確認されている。
また、動物モデルやヒトでの研究により、細菌叢の慢性的なアンバランスが炎症性サイトカインTNF-α、IL-1β、PGE-2の分泌を制御することが明らかにされている。
興味深いことに、これらの炎症性分子はIDDと相関がある。
これらを総合すると、腸管免疫系を変化させて炎症を増強することによってディスバイオシスを誘発しうる環境因子が存在することが強く示唆される。
・ディスバイオーシス、IVD変性と腰痛
細菌叢の変化や細菌に対する宿主の応答が病的な骨の発生や退縮を引き起こすことから、「腸-骨髄軸」や「腸-骨軸」という概念が生まれた。
Rajasekaranらの報告を受けて、IDDや腰痛に重要な影響を及ぼす可能性のある「腸-椎間板軸」という概念も浮上してきた。
以下、腸内細菌と3つの異なる組織タイプとのクロストーク、それらがどのように腰痛に関与しているかの説明
・腸-骨髄軸
腸内細菌の異常は、関節炎、糖尿病、肥満の動物モデルにおいて腸管バリア透過性を高め、腸の炎症を増加させる。
腸内細菌叢の変化は、複合糖質の発酵によって生成される短鎖脂肪酸(SCFAs)などの特定の炎症因子の分解を促進したり、LPS(リポポリサッカライド)などの細菌産物の漏出を促進することによって、低悪性度炎症を誘発すると考えられている。
この低悪性度炎症は、骨髄分化一次反応遺伝子88の発現を変化させることにより、腸管上皮バリアを調節する。
また、腸内細菌は末梢免疫細胞や骨髄造血幹細胞・前駆細胞(BM HSPCs)にも影響を及ぼすことがある。このことは、無菌マウスにおいて骨髄系前駆細胞の数が減少していることからも明らか。さらに、rag1欠損マウスはHSPCの数が少なく、これは野生型マウスの糞便を移植することで回復することがわかった。
肥満の場合、腸内細菌はBMの機能を破壊してHSPCの分化を変化させる可能性があることが示された。
また、脊椎は免疫細胞の豊富な供給源で、腸内細菌の異常は骨髄からの異常な免疫細胞形成を引き起こす可能性がある。
これも全身的な炎症の根源であり、間接的に腰痛につながる可能性がある。
したがって、腸-骨髄軸の存在は、遠くの臓器に対するマイクロバイオームの機能を理解するのに役立つと思われる。
・腸-骨軸
食物による栄養摂取後に腸内で分泌される腸ホルモンは、グルコース代謝ホメオスタシスや食物の代謝過程を調節し、腸ホルモンのいくつかは骨再形成の調節に関与している。
骨代謝バイオマーカーは食事摂取後ゆっくりと減少し、骨形成に比べ骨吸収に大きな影響を与える。
食事摂取後、腸の腸内分泌細胞はサイトカインやホルモンを分泌して様々な代謝プロセスを制御している。
例えば、SCFAは骨細胞を調節することで筋骨格系を変化させる。
胃酸分泌抑制ポリペプチド(GIP)およびグルカゴン様ペプチド1(GLP-1)は、インスリン分泌を増幅する腸内分泌ホルモンで、インスリンを介した骨形成の増加を刺激することが可能。
GIP受容体をノックアウトしたマウスでは、骨密度(BMD)の減少(生後5カ月で野生型に比べて総BMDが3.7%減少)、骨強度、骨形成マーカーであるアルカリホスファターゼやオステオカルシンの減少が認められている。
多くの研究で変化しやすいBMDレベルが腰痛と正の相関を持つことが証明されている。
・腸管-椎間板軸
IVDは繊維軟骨で、人体最大の無血管構造と考えられている。
IVDの血管は、縦靭帯と環状線維の外層にのみ存在する。
しかし、硬膜外腔への椎間板ヘルニア、物理的損傷や骨折、椎間板の局所的な炎症が起こると血管新生が起こる。
したがって、変性した椎間板への血管の浸潤も検出される。
腸内細菌は腸内環境を変化させて骨に有益と思われる様々なシグナル分子、免疫細胞、代謝産物の産生を促進する。このレビューの著者は、主に血流を介してIVDに細菌が影響を及ぼすと仮定している。
腸内細菌が産生するこれらの代謝産物や生体分子は血流に乗って遠隔組織に到達し、局所的な病的変化を引き起こす。
既存のエビデンスから、マイクロバイオームはIVDの外部および内部の微小環境を変化させたり調節したりすることで、IDDを誘発・悪化させる重要な因子となりうると思われる。
下の図は、腸内細菌叢がIVDを誘発し、LBPを引き起こす3つの潜在的なメカニズムを示したもの。
(1) 細菌が腸管上皮バリアを通過してIVDに移動。
(2) 粘膜・全身免疫系の制御
(3) 腸管上皮での栄養吸収・代謝産物形成とIVDへの拡散の制御。
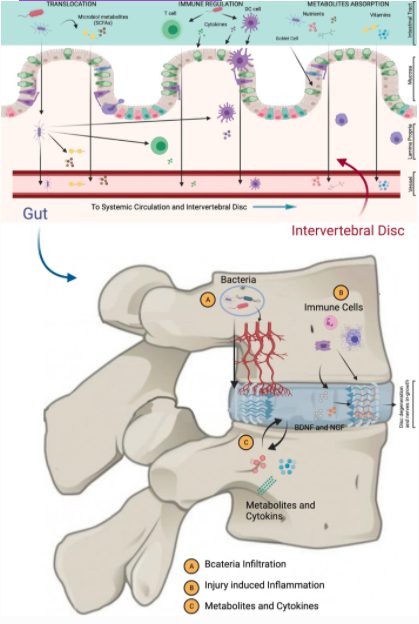
椎間板変性を制御しうる腸管上皮障害シグナルモデル。
腸内細菌は、腸内細菌叢の転座と組成を調節して腸管透過性と炎症を増加させ、代謝物の吸収を修飾することによって腸内環境を変化させる。
これらの変化は、IDDを引き起こす可能性のある局所的および全身的な反応を引き起こす可能性がある。
A病原体の移動、B免疫系の修飾、C微生物代謝産物の産生とサイトカイン
・腸管上皮バリアーを越えてIVDに移行する細菌
ディスバイオーシスと関連する低レベル炎症が、関節リウマチのような筋骨格系疾患の発症に不可欠な要因であることを裏付ける証拠が増えている。
腸とIVDにおけるディスバイオーシスが、IDDやヘルニア、そして腰痛に関連している可能性もありえる。
健康なIVDの微小環境は、中枢神経系(CNS)と非常によく似ている。
中枢神経系の血液脳関門(BBB)と血液脊髄関門同様に、血液ディスクバリアは循環系の他の潜在的な炎症からIVDを隔離しているが、同時に、免疫系がIVD内で開始する免疫監視(見張り役)をも遮断している。免疫細胞は、椎間板内側の微小環境からタイムリーなフィードバックを得ることができず、炎症反応を悪化させる原因となる。
つまり、椎間板の免疫監視機能の欠如と低酸素状態が、椎間板に侵入した嫌気性菌の繁殖に理想的な条件を育んでいる。
さらに、腸の炎症は腸の透過性を促進し、より多くの細菌が上皮バリアを通過する。
炎症性細胞の浸潤はIVDに血管を新生させ、IVDの適切な嫌気性環境を破壊する。
さらに、異常な機械的負荷や慢性的な微細損傷も、不可逆的なIVD損傷や微細骨折の形成を誘発する可能性がある。
微細骨折は免疫細胞のIVDへの侵入を可能にし、IVDの損傷をさらに悪化させる。
IVD内部の炎症はIVD細胞による同化反応と異化反応のアンバランスを誘発し、IDD、ヘルニア、椎間板性腰痛の原因となる。
さらに、損傷したIVDから分泌される炎症性分子の放出や、マクロファージ、T細胞、B細胞、マスト細胞、好中球の活性化は、炎症カスケードをさらに増幅し、その結果IDDが引き起こされる。
また、IVDへの細菌の侵入はリポポリサッカライド(LPS)の放出によってこれらの免疫細胞の活性化を引き起こし、持続的な痛みを引き起こす。
またこのような炎症は、痛みを増幅させ、後根神経節(DRG)や脳にある末梢求心性神経線維にペインシグナルを伝達する神経の変性IVDにおける神経支配を増加させる。
・粘膜および全身免疫系の制御
IDDは、IVD細胞(髄核細胞、環状線維細胞)自身や免疫細胞(好中球、T細胞、マクロファージなど)による炎症性因子の異常産生と相関があることが証明されている。
これらの分子は、IVDにおける一連の病原反応や炎症反応を引き起こし、老化、アポトーシス、オートファジーを活性化してIDDの原因となる。
腸内細菌叢は、ヒトの免疫系と相互にコミュニケーションをとっており、免疫系はマイクロバイオームの局在や組成を制御している。
腸内環境が悪化すると、上皮バリアが弱くなり、透過性が高まり、腸内細菌叢と粘膜免疫系との接触が増加する。この過剰な接触は、活性化した免疫細胞の大量流入を引き起こし、大量の炎症性サイトカイン(IL-6やTNFαなど)を血流に放出し、骨の代謝を調節する。
これらの炎症性サイトカインや活性化した免疫細胞は、IVD付近に移動・集積し、骨吸収やリモデリングを調節することでIDDを誘発する。
特に、IVDへの免疫細胞の移動はIVDの細胞を刺激し、脳由来神経栄養因子(BDNF)や神経成長因子(NGF)などの神経発生因子を生成させる。
これにより、後根神経節(DRG)だけでなく、IVDの侵害受容神経線維の出現が誘導される。
さらに、免疫細胞は、炎症環境を作り出すことにより、DRGの疼痛関連カチオンチャネルの発現を上昇させる。
・IVDの石灰化は、骨芽細胞の形成と相関している。
動物実験では、C57BL/6マウスや骨粗鬆症マウスにプロピオン酸や酪酸を投与すると、破骨細胞の数が減少することが示された。
SCFAは、ナイーブCD4 +細胞のTregへの分化を促進し、骨の骨内表面に優先的に存在する。
Tregは骨芽細胞分化を促進し、破骨細胞形成を抑制し、さらに、副甲状腺ホルモン刺激(PTH刺激)骨形成にも必要であるとされている。
また、SCFAはGPCRの活性化やヒストン脱アセチル化酵素(HDAC)の阻害を介して、骨吸収や破骨細胞の形成を抑制する直接的な作用がある。
さらに、椎間板におけるカルシウム沈着と細胞外カルシウム感知受容体(CaSR)の発現は、変性した椎間板におけるGPCRと密接に関連していることから、腸由来SCFAがIVDに拡散することは石灰化とIDDにつながる可能性があることを意味している。
また、SCFAs は体内免疫細胞の炎症性表現型を誘導し、神経因性疼痛の発症につながる可能性がある。
以上
SCFAsに関して、過去に目を通したデータとは真逆の見解が記載されているので、SCFAsに関してはさらなる情報の精査が必要という感想。
細菌の種類によって代謝物が関わる経路が異なるように、SCFAsに関しても細菌の種類によるところが大きいのかもしれない。