母親の栄養状態が胎児の成長と発達に重要な役割を果たすことを疑う人は少ないだろう。
DOHaD仮説は、胎児期や生後間もない時期の有害事象(栄養失調など)が将来におけるなんらかの疾患発症のリスクを高めることを支持している。
以前のブログでもマウスモデルの研究など、妊娠中の母親の栄養状態が子孫に与える影響についていくつか記事を書いた。
今回のブログは、高血圧、肥満、糖尿病、腎臓病などにに潜在的な役割を担っていると考えられている妊娠中のフルクトース摂取と腸内細菌叢に関するデータをまとめてみたい。
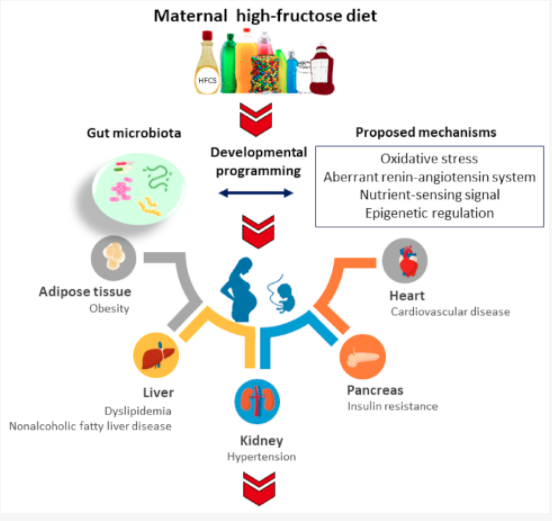
最近の研究によると、妊娠中のフルクトース摂取量の増加は高血圧、肥満、糖尿病、心血管疾患、非アルコール性脂肪肝疾患など、胎児プログラミングによって子孫に様々な有害な結果をもたらすことを示している。
また、フルクトースの過剰摂取は腸内細菌叢に波及する可能性が示されている。
腸におけるフルクトース吸収は選択的吸収のため制限されており、未吸収のフルクトースは腸内細菌叢によって水素、短鎖脂肪酸(SCFA)、メタンおよび二酸化炭素に変換される。
したがって、高フルクトース食は腸内細菌叢異常や代謝産物の乱れを引き起こす可能性がある。
これまでも母親の高フルクトース食による成人病の発症リスクは腸内細菌叢とその代謝産物の変化と関連していることが示されてきたが、知見にはまだギャップがある
動物モデルから得られたエビデンスによると、母親のフルクトース摂取は成人した子孫にメタボリックシンドロームの様々な症状を引き起こすが、一方でフルクトースによる発達プログラミングと子孫の慢性疾患発症リスクに対する腸内マイクロバイオームの関与についてはほとんど分かっていない。
リンクのレビューは、フルクトースと成人病の発達プログラミングとの関連を支持する現在のエビデンスを要約し、腸内細菌叢がフルクトース誘発性発達プログラミングの根底にある共通のメカニズムとどのように関連しているかを提示している。
さらに、フルクトース誘発性発達プログラミングに対する腸内細菌叢標的治療によるリプログラミング効果の概要と成人病を予防できる可能性について説明しており非常に興味深い。
The Impact of Gut Microbiome on Maternal Fructose Intake-Induced Developmental Programming of Adult Disease
・妊娠中のフルクトース摂取は成人病をプログラムする
現在のフルクトース消費は、ほとんどが精製糖や高果糖コーンシロップ(HFCS)でできた加工食品に由来しする。
様々な研究から、フルクトースの過剰摂取は肥満および代謝異常発症の危険因子であることが明らかにされている。15のヒトの研究を検索したメタアナリシスでは、フルクトースの消費は収縮期血圧(BP)の上昇、空腹時血糖値の上昇、およびトリグリセリドの上昇と正の相関があることが実証されている。
別のメタアナリシス研究では、フルクトースを含む砂糖入り飲料は高血圧発症リスクと関連することが実証された。
果物に含まれるフルクトースは、果物に含まれる追加の栄養素や抗酸化物質との相互関係で安全な傾向があるが、高果糖コーンシロップ(HFCS)や精製糖に含まれる果糖はほとんどが有害。
しかしこれまでのところ、ヒトにおける妊娠中および/または授乳期のフルクトースの過剰摂取が子孫の健康に及ぼす影響に関するデータは存在しない。
母親のフルクトース摂取が子孫の健康に及ぼす影響について知られていることの多くは、実験動物モデルに基づいているに過ぎない。
動物モデルでは、母親のフルクトース食が、肥満、高血圧、脂質異常症、インスリン抵抗性など、子孫にメタボリックシンドロームの様々な要素を引き起こすという証拠が報告されている。
さらに母親の高フルクトース消費は、空間学習・記憶障害、網膜症と関連している。
・フルクトースと腸内細菌叢
腸内細菌叢の機能として、腸構造の完全性の維持、宿主の栄養代謝、免疫恒常性の調節、異物質および薬剤代謝、難消化性基質の発酵などがある。
腸内細菌叢のバランスの喪失はディスバイオーシスと呼ばれ、多くのヒトの疾患に関与する。
腸内細菌叢由来の代謝産物、特に胆汁酸、SCFA、分岐鎖アミノ酸、トリプトファン誘導体、トリメチルアミンN-オキシド(TMAO)は、代謝性疾患の病因に関連する。
最近のデータでは、メタボリックシンドローム関連疾患におけるフルクトースと腸内細菌叢のディスバイオーシスとの関連性が示されている。
先行研究では、健常者とメタボリックシンドローム患者で腸内細菌叢の組成が異なることが報告されている。
・フルクトースが腸内細菌叢とその代謝産物を変化させる機序
タイトジャンクションは透過バリアを形成し、腸内細菌とその産生物の侵入を回避することで宿主を守っている。フルクトースの慢性的摂取は、腸のタイトジャンクションタンパク質の喪失を伴い、エンドトキシン(内毒素)のトランスロケーションを上昇させる。
マウス研究では、高フルクトース食を与えると高血糖、脂肪、脂質異常症、エンドトキシン血症、耐糖能異常が発症し、ディスバイオーシスが誘発されることが示されている。
別の研究では、高フルクトース食は脂質異常症を伴う脂肪症を誘発し、有益な微生物であるビフィドバクテリウムおよびラクトバシラスの減少と関連していた。
さらに、高フルクトースおよび食塩を与えたラットの代謝プロファイリングでは、尿中のTMAOの増加は、インスリン抵抗性および高血圧状態へと進行する代謝的進行軸と関連していることが示された。
つまり、フルクトースは腸管バリアを破壊して内毒素血症と炎症を誘発し、腸内細菌叢プロファイルと多様性を変化させ、細菌代謝産物に影響を与える。
・母親のフルクトース食が腸内細菌叢に与える影響
フルクトースの子孫の腸内細菌叢へのプログラミング効果については少ないデータしか存在しない。
腸内細菌叢、母親の高フルクトース摂取、その後の成体子孫の疾患発症との関連を示す動物実験の概要。
主な有害事象は高血圧。

妊娠中ラットの飲料水に10%の果糖を加えると、母体のマイクロバイオームが大きく変化する。
特に、有益な細菌として知られているラクトバチルスとバクテロイデスが著しく減少した。
この雌の子孫は、8週齢で脂質異常症およびインスリン抵抗性を発症した。
これらの所見は、子孫のタイトジャンクションタンパク質の発現の低下と関連していた。
同様に、母親の高フルクトース食はラット子孫のマイクロバイオームも変化させる。
母親の高フルクトース食によって誘発された成体雄子孫の高血圧は、アッケルマンシア属の存在量の減少に関連していた。
別の研究では、妊娠中および授乳期にフルクトース食を与えられた母親から生まれた成体子孫は、高血圧の微生物マーカーであるファーミキューテス/バクテロイデス比の上昇を示した。
また、母体と離乳後の高フルクトース食によるプログラミングが高血圧を引き起こし、ラクトバシラス、リューコノストック、ツリシバクター属の存在量の低下と一致した。
さらに、母親の高フルクトース食は成体子孫の微生物叢組成だけでなく、その代謝物も変化させる。
母親の高フルクトースプログラミング高血圧と、腸内細菌の代謝物であるトリメチルアミン(TMA)および酢酸との間に関連があることが判明した。
TMAは、TMAOの微生物叢由来前駆体である。TMAOと同様に、TMAは心血管リスクマーカーとして浮上している。
・主なSCFAは、酢酸、プロピオン酸、酪酸
SCFAは、Gタンパク質共役型受容体41(GPR41)などのSCFA受容体と結合することで血圧を調節することを示す証拠がある。
母ラットにフルクトース食を与えると成体子孫の血圧が上昇するが、これは血漿酢酸濃度の上昇と腎臓のGPR41およびGPR43発現の減少に関連している。
酢酸は血管収縮を誘導し、GPR41は血管拡張作用を示すことから、SCFAsとその受容体が母親の高果糖食プログラミングが子孫の高血圧に関与している可能性を示唆した。
早期の腸内細菌叢の異常は子孫において、肥満、インスリン抵抗性、脂質異常症、非アルコール性脂肪肝、心血管疾患(CVD)など、多くの有害な結果と関連していた。
これらの疾患はすべて、フルクトースによる発育プログラミングと関連している。
プロバイオティクスとして乳酸菌を介入させた以前の研究では、フルクトースで飼育したラットとマウスの脂肪肝とII型糖尿病の進行を遅らせることが実証されている。
さらに、母親のラクトバチルス・プランタルム摂取は、成人子孫のCVDリスクを抑制した。
また他の先行研究では、母親のフルクトースの過剰摂取は胎盤の尿酸レベルの上昇と関連していることが示されたが、キサンチンオキシダーゼ阻害剤アロプリノールで母親マウスを処理すると胎盤尿酸レベルが低下し、胎児の体重と血清トリグリセライドが改善した。
尿酸は高フルクトース摂取関連障害のメディエーターで、ラクトバシラスやシュードモナスなどの腸内細菌が尿酸の代謝に関与することから、腸内細菌叢を標的とした尿酸低下作用を有するプロバイオティクスラクトバシリがフルクトース誘発プログラミングの治療法となる可能性は、今後の研究課題である。
・フルクトースによる発達障害の共通メカニズムと腸内細菌叢の関連性
腸内細菌叢の異常に加えて、フルクトースによる発育プログラミングとその結果として生じる成人病には多くのメカニズムが関与している。
これらの分子機構には、酸化ストレス、レニン-アンジオテンシン系(RAS)異常、栄養感知シグナル、エピジェネティック制御、アラキドン酸代謝経路などが含まれる。これらの中には、腸内細菌叢と相互に関連しているものがある。
*酸化ストレス
胎児は抗酸化力が低いため、発育中の酸化的損傷に対して脆弱である。
母親の高フルクトース食が成人した子孫に誘発するメタボリックシンドロームの様々な特徴(脂質異常症 、インスリン抵抗性 、高血圧)は、酸化ストレスと関係があるとされている。
酸化ストレスは、非対称ジメチルアルギニン産生(ADMA、NO合成酵素の内因性阻害剤)を増強することによって、一酸化窒素(NO)産生を低下させることがある。
血漿ADMAレベルの上昇とNOバイオアベイラビリティの低下は、母親のフルクトース食誘発性プログラミング高血圧で報告されている。
一方で、抗酸化物質は酸化ストレスを軽減し、成人病を予防することができる。
妊娠中および授乳期における抗酸化物質の使用は、母親の高フルクトース摂取によってプログラムされた高血圧に対して有益な効果を有することが示されている。
フルクトースによって誘発される発育プログラミングは、腸内細菌叢との関連も指摘されている。
腸内細菌叢は酸化還元シグナルを誘発し、宿主-細菌叢の恒常性を維持する。
酸化還元状態の不均衡が生じると、炎症反応が副次的な組織損傷や末端器官の機能不全を媒介する可能性がある。
*レニン-アンジオテンシン系(RAS)の異常
RASは発達プログラミングに起因する成人病と密接な関係がある。
ACE/アンジオテンシンⅡ(ANGⅡ)/ANGⅡタイプ1受容体(AT1R)の活性化は、血管収縮、酸化ストレス、および炎症を誘発する。
母体の高フルクトース食による高血圧は、腎臓における(プロ)レニン受容体、アンジオテンシノーゲン、アンジオテンシン変換酵素(ACE)の増加で表されるRASの異常な活性化に関連している。
最近の研究では、腸内マイクロバイオームとRASの間の双方向の相互作用が示唆されている。
腸内細菌叢由来の代謝産物は腸内RASを調節し、RASの変化はマイクロバイオータ組成および代謝活性を形成する。
母親のフルクトース摂取が腸内細菌叢とRASを同時に変化させることを考慮すると、フルクトース誘発発育プログラミングの病因に関与する腸内細菌叢とRASの相互作用を探るためのさらなる研究が必要。
*栄養感知シグナル
胎児の発育中、栄養感知シグナルが母体の栄養状態に応答して胎児の代謝を調節する。
妊娠中に撹乱された栄養感知シグナルは、発達プログラミング由来成人病の病因で特徴的な役割を担っている。
silent information regulator transcript (SIRT)
AMP-activated protein kinase (AMPK)
peroxisome proliferator-activated receptors (PPARs)
PPARγ coactivator-1α (PGC-1α)
など、多くのシグナルが発達プログラミングに関連している。
妊娠中および離乳後の高フルクトース食ラットモデルにおいて、AMPK、PGC-1α、およびPPARの腎mRNA発現が減少することが示された。
逆に、AMPK活性化剤であるレスベラトロールは、これらの栄養感知シグナルを媒介してPPAR標的遺伝子を活性化し、メタボリックシンドローム関連のプログラムプロセスから子孫を保護することがわかっている。
*エピジェネティック制御
遺伝子のエピジェネティック修飾は、発生プログラミングの重要なメカニズム。
修飾には、DNAメチル化、ヒストン修飾、ノンコーディングRNAが含まれ、これらはすべて遺伝子の活性化または抑制を制御している。
以前の研究では、母親の高フルクトース摂取にさらされた生後1日の雄子孫の腎臓トランスクリプトームの著しい変化を観察した。
合計2706個の発現差遺伝子(DEGs)が同定され、その中でアラキドン酸代謝に属するCyp2c23などが母親の高フルクトース食誘発性高血圧に関与していた。
追跡調査では、生後1日目の様々な臓器において、フルクトース代謝、脂肪酸代謝、解糖/グルコネシン生成、インスリンシグナルを調節する多くの遺伝子が、母親の高フルクトース食によって調節されているようだった。特に、母親の高フルクトース食は、子孫の脳、腎臓、心臓、膀胱における遺伝子発現の差異変化を誘発した。
腸内細菌叢とその代謝産物は、複数の宿主組織に対してエピジェネティックなプログラミングを行う能力を有していることが示されている。
SCFAsはヒストンアセチルトランスフェラーゼ(HAT)酵素の基質であるアセチル-CoAを形成することができる。
さらに、酪酸はヒストン脱アセチル化酵素(HDAC)阻害剤として知られている。
どちらのシナリオもヒストンの修飾に影響を与える可能性がある。
*腸内細菌叢を標的としたリプログラミング戦略
発達プログラミングに関する理解が高まり、疾患が発生する前でも、治療アプローチを成人期から幼少期に移行させることができることが判明している。これをリプログラミングと呼ぶ。
研究者はリプログラミングにおける治療薬の標的として、腸内細菌叢に注目している。
*腸内細菌叢をターゲットにした治療法
腸内細菌は、プロバイオティクス(有益な微生物)、プレバイオティクス(有益な微生物のための栄養または食物)、シンバイオティクス(プロバイオティクスとプレバイオティクスの混合物)、ポストバイオティクス(腸内細菌の代謝によって生成される物質)、および糞便細菌叢移植などの様々な様式で標的とすることが可能。
腸内細菌叢を標的とした治療法として広く臨床利用されているのは、プロバイオティクスとプレバイオティクス。
他の研究でも、腸内細菌叢標的療法は広範囲の疾患に対して利益を示している。
ヒトを対象とした研究の結果、妊娠中のプロバイオティクスが母体の予後に有益な影響を及ぼすことが報告されているが、DOHaD関連疾患から子孫を保護する効果についてはほとんどわかっていない。
*リプログラミング戦略としての腸内細菌叢標的療法
フルクトース誘発性プログラミング動物モデルにおける腸内細菌叢を対象とした介入とリプログラミング戦略を文書化した研究の要約。
注目すべきは、腸内細菌叢を標的とした治療法はヒト受精卵初期発生中の重要な時期にのみ限定される。
文献レビューでは、フルクトース誘発性発達プログラミングに関連した腸内細菌叢標的治療のリプログラミング効果に関する報告はわずかしかない。
報告されているリプログラミングのための介入は、プロバイオティクス、プレバイオティクス、ポストバイオティクスからなる。
糞便細菌叢移植は、高フルクトース食ラットモデルにおいてメタボリックシンドローム関連の表現型を救済することも示されているが、フルクトース食の母親から生まれた子供に対するそのリプログラミング効果はまだ研究されていない。
いくつかのプロバイオティクス細菌は健康上の利点と関連しているが、フルクトース誘発性発達プログラミングに対するそれらの役割を示唆する情報は今のところない。
妊娠中および授乳期にラクトバチルス・カゼイを補給すると、高フルクトース食誘発性高血圧から成体雄ラットの子孫を保護することを記録した研究は1件のみ。
母親の高フルクトース食誘発性高血圧に対するラクトバチルス・カゼイ補給の有益な効果は、血漿酢酸レベルおよび腎臓Olfr78発現の減少に関連する。酢酸がOlfr78の活性化によって高血圧を誘発することを考慮すると、SCFAとその受容体が母親のプロバイオティクス治療の保護効果に関与していると考えられる。
同じ研究で、妊娠中および授乳期におけるイヌリンの補給は、母親の高フルクトース食誘発性高血圧から子孫を保護し、血漿プロピオン酸レベルおよび腎臓GPR43発現の上昇と関連した。
プロピオン酸はGPR43を活性化して血管拡張を誘発することができるため、イヌリンの保護作用は腸内細菌叢由来の代謝物SCFAに起因するものである。
フラボノイド、ポリフェノール、ビタミンなど、機能性食品にはプレバイオティクスに似た成分が多く存在するため、その臨床利用が広まるにつれ、フルクトース誘発性プログラミングに対するそれらのリプログラミング効果をより良く理解する必要性が高まっている。
SCFAは腸内細菌叢による多糖類の発酵産物で、ポストバイオティクスとして利用されている。
今のところ、母親の高フルクトース食誘発性高血圧がSCFAの補給によって保護されることを示した報告は一件のみ。
その保護効果は、血漿TMAレベルおよびTMA-TMAO比の減少、およびSCFA受容体の発現の増加と関連している。腸内細菌叢に依存したTMAおよびTMAOの形成は心血管リスクに関連している。母親のTMAO投与は、成人男性の子孫に高血圧をプログラムすることが報告されている。
逆に、TMAの阻害は、フルクトース曝露された子孫においてリプログラミング効果を示す。
現在までに、妊娠中および授乳期のDMB投与が、母親の高フルクトース食誘発性高血圧から成体子孫を保護することが2つの研究で示されている。
*結論と今後の展望
このレビューで紹介したメカニズムが、腸内細菌叢の変化に関連するフルクトース関連プログラミング効果の全体像をカバーしているわけではない。。
フルクトース誘発性発達プログラミングと腸内細菌叢異常の背後にあるメカニズムを徹底的に調べることは価値がある。
フルクトースは多くの臓器をプログラムし、その結果、成人した子孫に異なる表現型をもたらすことを考えると、臓器特異的なリプログラミング効果に関する研究が急務であり、他の腸内細菌叢関連の介入を評価することも必要。
フルクトースによる発達プログラミングの理解はフルクトース関連疾患の世界的大流行を抑える貴重な戦略になると期待される。