本日のブログは、個人的に非常に興味を持っている分野である、腸内細菌叢と腸-脳軸関連のお話。
うつ病発症における腸内細菌叢の影響とその背景にあるメカニズムについての考察をまとめていきたい。
リンクのレビューは、
うつ病性障害はディスバイオーシスを引き起こすのか?
腸内細菌叢の変化がうつ病につながるのか?
という二つのテーマについて考察している。
The Role of the Microbiome-Brain-Gut Axis in the Pathogenesis of Depressive Disorder
・メタゲノム
マイクロバイオータとは、人体に生息するすべての微生物(細菌、真菌、ウイルス、古細菌)を指し、マイクロバイオームとはそれらのゲノムの集合体を指す。
その大きさはヒトゲノムの100倍にもなり、宿主ゲノムとマイクロバイオームが共通の “メタゲノム” を構成している。
腸内細菌は腸内細菌叢の支配的な集団で、腸内遺伝子の最大99%を占める。
このうち最も数が多い4つの門、バクテロイデーテスとファーミキューテス、プロテオバクテリア、アクチノバクテリアに区別することができる。
・脳と腸はどのようにコミュニケートしているのか?
最近の研究で、マイクロバイオータは中枢神経系に影響を与え、脳と腸の相互的双方向関係を促進する能力があることが指摘されている。
脳と腸はマイクロバイオータを通じて、神経内分泌、神経免疫、感覚神経の分子経路を経由して、互いの機能に影響を及ぼしている。
このコミュニケーションシステムには、視床下部-下垂体-副腎(HPA)軸と腸管ペプチドの両方が関与している可能性がある。
また、脳と腸内細菌叢の関連は、ストレス、不安、認知、そしてうつ病、双極性障害、統合失調症、不安症などの精神疾患に大きな影響を与える可能性があると言われている。
障害の時系列的な順序は確立されていないため、うつ病が腸内細菌叢の異常を引き起こすのか、それとも細菌叢の組成の変化がうつ病を促進するのか、正確には分かっていない。
マウス実験では、うつ病患者の糞便を移植したマウスにうつ病性疾患が発症した。
また、抑うつ行動を示し、ストレスを経験したマウスでは腸内細菌叢の変化と多様性の減少が確認されている。
・腸内細菌叢とは?
腸内細菌叢とは、ヒトや昆虫を含む動物の消化管に生息する数兆個もの微生物が織りなす生物群集のことで、微生物叢はヒトの身体の体細胞や生殖細胞よりも10倍多く存在している。
ヒトの腸内細菌叢は、細菌、古細菌、真核生物、ウイルス、寄生虫など数種類の微生物からなり、その重さは約1kgに達し、消化管(GI)の保護システムになっている。
腸内環境は、ファーミキューテス、バクテロイデテス、アクチノバクテリアなど7つの優勢な門の細菌が繁殖しており、このうちバクテロイデテスとファーミキューテスが全体の90%以上を占める。
ヒトの場合、腸内細菌叢は身体の他の部位と比較して、最も多くの微生物が存在し、その種数も多い。
出生時に獲得された微生物叢は宿主と並行して発達し、成人してから死亡するまで、その時間的安定性と多様性を維持する。
腸内細菌叢は動的だが、免疫学的、代謝学的、構造学的、神経学的な基本的機能を果たしている。
代謝的な役割は、食物元素を生理活性物質に変換すること。腸内細菌は食物繊維から約10-30%のエネルギーを大腸で回収し、残りは糞便として排泄される。
腸内細菌は、リグニン、非デンプン性多糖類、レジスタントスターチ、オリゴ糖など、宿主の消化酵素で消化されにくい糖質を利用するための酵素を多数保有している。
腸内細菌叢は食物繊維をすべて発酵させ、その結果、ガス、短鎖脂肪酸(SCFA)、有機酸、アルコールが放出される。
SCFAsは、酢酸、プロピオン酸、酪酸が最も多く、宿主のカロリー需要の約10%を満たし、その主な生産者はローズブリア属、ユーバクテリウム・レクターレ、フィーカリバクテリウム・ プラウスニッツィイ、クロストリジウム属。
SCFAには抗炎症作用や化学物質の予防作用も期待されている。
MEROPSデータベースによると、腸内細菌叢は様々なペプチダーゼやプロテアーゼ酵素を持っており、クロストリジウム属、バクテロイデス 属、ラクトバチルス属は、保有する酵素の多様性から特に重要とされている。
腸内細菌叢は、腸の表面を占拠し、安定したシステムを構築することで病原性微生物の侵入を防ぎ、保護する役割を担っている。
また、粘膜バリアの上皮細胞は、SCFAをエネルギー源として利用している。
また、腸内細菌はSCFAs、食事からのカルシウムとリンの吸収の調節、破骨細胞-骨芽細胞を介した骨再構築プロセスの乳酸菌属による免疫調節を通じて、骨の成長と発達に大きな影響を与えることが示されている。
さらに腸内細菌叢は、神経伝達物質や神経栄養因子の産生・発現、腸管感覚神経の調節、代謝物産生、粘膜の免疫調節、腸管バリアやタイトジャンクションの完全性維持など、様々なメカニズムで中枢神経系と腸管神経系の両方を制御する。
・腸内細菌叢の構成と機能を変化させる要因。
宿主の遺伝子が腸内細菌叢組成に影響を及ぼすことが多くの研究で指摘されている。
また、パターン認識受容体はマイクロバイオームの構成とそれに関連する疾患を調節する。
出生後、腸内細菌叢は吸収された栄養素に適応するため、主に食事によって形成される。
まず、母乳のオリゴ糖代謝に関わる遺伝子に富み、その後、多糖類やビタミンの消化に関わる遺伝子に富む。母乳育児では放線菌が過剰に増殖し、ファーミキューテス属とプロテオバクテリア属が抑制されるのに対し、人工ミルク栄養児では、クロストリジウム、連鎖球菌、バクテロイデス、腸内細菌科が増加する。
ベジタリアンは、ファーミキューテスとバクテロイデス の優位性を示す。
胆汁耐性種(バクテロイデス , ビロフィラ, アリスティペス)の多さとファーミキューテスの抑制は、タンパク質と脂肪を多く含む食事と相関する。
微生物叢の構成に大きく影響するもう一つの要因は年齢。
生後1年間は細菌叢発達の最も重要な時期であると考えられている。出生時の分類学的多様性は低いが、時間の経過とともに増加する。
成人の腸内細菌叢はファーミキューテスとバクテロイデス が優勢で、高齢者ではバクテロイデス とファーミキューテスの比率が低下し、ビフィドバクテリウム、アミロ分解活性、SCFAs産生の減少、腸内細菌科が豊富になる。
運動は、健康的なライフスタイル全般、トレーニングへの本質的な適応、炎症レベルの低下、罹患率の低下、代謝マーカーの改善など、内外の要因によって微生物叢の多様性を増大させる。
アスリートでは、非アスリートと比較して、ファーミキューテスが豊富で、バクテロイデテスの量が少ない。
抗生物質は病原性微生物と有益微生物の両方を破壊し、腸内細菌叢の乱れであるディスバイオーシスを引き起こしていることが分かっている。
抗生物質の種類と投与期間は、腸内細菌叢への影響と関連している。
喫煙は微生物叢の構成に影響を与え、その影響が口腔内で最も顕著であることが研究により明らかにされている。
微生物組成の変化に伴う腸内細菌叢の乱れは、炎症性腸疾患(IBD)、肥満や糖尿病、アレルギー、自己免疫疾患、循環器疾患と関連していることが証明された。
近年、ヒトの腸内細菌叢は大きな関心を集めており、メタゲノム研究の増加に伴い、その種や潜在的な用途に関する知識も増えてきている。
・大うつ病性障害(MDD)とは?
大うつ病性障害(MDD)の患者数は3億5千万人以上と言われており、潜在的な抑うつ症状に悩む未診断の人々の数はさらに多いと推定されている。
高所得国と低・中所得国を比較して、12ヶ月間のMDDの有病率がほぼ同じであることから、MDDが先進国の現代的なライフスタイルの直接的な結果でも貧困の結果でもないことを示している。
常に憂うつな気分、罪悪感、快感消失、無価値感、気力の欠如、集中力の低下、食欲の変化、精神運動性の鈍化や焦燥、不眠などの睡眠障害、自殺願望などの症状がある場合にMDD診断が下される。
うつ病は、視床下部-下垂体-副腎(HPA)軸の機能異常と関連している。
また、大脳辺縁系における構造的変化もうつ病の病態に重要な役割を果たしている可能性がある。
この仮説は、生化学的および病理組織学的所見によって裏付けられている。
これまでに解明されたいくつかのメカニズムから、腸内細菌叢とうつ病を含む中枢神経系との間には双方向的な影響があることが示唆されている。うつ病が腸内細菌叢に及ぼす影響は、ストレス、腸内の神経伝達物質やその他のシグナル伝達分子の放出の変化、免疫反応の調節異常に影響を受けている。
・うつ病性疾患はディスバイオーシスを引き起こすか?
ストレスと胃腸障害
消化器疾患の基礎を理解する上での生物心理社会的モデルは、1998年にDrossmanによって初めて提唱された。これまで、消化器疾患は主に生物医学的な観点から考えられてきたが、Drossmanの研究は、胃食道逆流症やクローン病の増悪にストレスが、消化器痛の発生に中枢神経系が制御する内臓知覚過敏が含まれると主張するものだった。
動物モデル(げっ歯類)を用いた実験では、げっ歯類の微生物叢はヒトの微生物叢と定量的に異なるが、定性的には両者が類似していることが示されている。
また、実験室でネズミに作用する抑うつ刺激を制御し、個々のストレス因子をオン・オフすることは、ストレス因子の存在や数が複雑なヒトで同じことを行うより容易である。
動物モデルにおける抑うつ状態とディスバイオーシス-コミュニケーションルート
まず、動物モデルにおいてうつ病刺激とディスバイオーシスとの因果関係を仮説的に示すことに焦点を当てる。
ネズミに両側嗅球摘出を行うと、皮質-海馬-扁桃体回路に深刻な機能障害が起こり、不安様行動や抑うつ行動につながる行動変化が起こる。
中枢神経系のこれらの部分は、うつ病患者でも障害されていることが示されている。
嗅球を摘出した後のネズミの前頭前野の機能の変化は、ヒトのうつ病患者でも観察されている。ヒトの前頭前野の機能障害は、腹内側領域の過活動と背外側領域の低活動を包含する。
この手術法は、慢性的な抗うつ剤治療に反応するネズミの行動変化を誘発するため、精神科病棟での抗うつ剤による治療の時間経過を模倣している。
嗅球摘出後のマウス研究では、対照群に比べ副腎皮質刺激ホルモン放出ホルモン(CRH)の発現が高く、視床下部-下垂体-副腎(HPA)軸の活性が高まっていることが示された。
うつ病の状態と微生物叢組成には双方向の関係があるという論文を検証した実験では、研究者はうつ病患者34名と健常対照者33名の唾液、血清、糞便の組成を調べた。
うつ病患者では総コルチゾール、IL-6、IL-8、TNF-α、CRPの有意な増加、および高いキヌレニン/トリプトファン比が検出され、またうつ病患者の便サンプルでは観察される細菌種数が減少し、系統的な多様性も低いことがわかった。
また抑うつ症状は、1日の食物繊維摂取量と負の相関が認められた。
成熟期ラットにおける慢性的腸内細菌叢の枯渇がもたらす行動および神経化学的な影響について調査した研究では、成熟雄ラットに腸内細菌叢を枯渇させるために抗生物質を投与。対照群には何も投与しなかった。6週間後、すべてのラットに、脳内モノアミンレベル、マイクロバイオータ組成、不安行動、抑うつ行動、大腸膨満、中枢神経系における遺伝子発現などを評価する複数の試験を実施。
その結果、抗生物質投与により著しい抑うつ行動が見られ、海馬では5-ヒドロキシトリプタミン(5-HT)レベルが低下し、5-ヒドロキシインドール酢酸/5-ヒドロキシトリプタミン(5-HIAA/5-HT)ターンオーバーが増加し、トリプトファンレベル、線条体のノルエピネフリンレベル、前頭前野と海馬のレボドパ(L-DOPA)およびホモバニリック酸(HVA)レベルの増加がみられた。
抗生物質を投与したラットでは微生物の多様性が変化し、ファーミキューテスとバクテロイデスが著しく減少し、プロテオバクテリアとシアノバクテリアが増加していた。
成熟期のラットにおいて、抗生物質による微生物叢の枯渇と関連した抑うつ行動や認知障害などの明確な表現型が同定された。
抗生物質への慢性的な曝露は、腸内細菌叢の多様性と豊かさを減少させ、それはうつ病様行動の発生と一致した。
・慢性ストレスは炎症反応に影響を与える
大うつ病性障害で起こる慢性ストレス状態におけるグルココルチコイド受容体抵抗性(GCR)では、長期にわたるストレス要因の結果、より多くの炎症性サイトカインが産生され、炎症が抑制されないと、GCRモデルを提唱した研究者は発表している。
82研究のメタアナリシスにおいて、非うつ病患者と比べてMDD患者では炎症性サイトカイン(すなわち、IL-6、TNF-α、IL-10、可溶性IL-2受容体、IL-13、IL-18、IL-12、IL-1受容体拮抗薬、可溶性TNF受容体2、C-Cケモカインリガンド2)濃度の上昇が重要であることを示している。
いくつかの研究はうつ病における炎症基質の重要な役割を強調しており、無視できない。
・うつ病における腸内細菌叢の変化
コルチゾールおよびグルココルチコイドは、大腸上皮に局在するグルココルチコイド受容体 (GR)発現により、ほとんどすべての種類の免疫細胞に影響を及ぼす。その結果、嗅球摘出後のマウスでは大腸の運動性の変化が観察された。
これは、うつ状態が大腸の活動亢進を通じて腸内細菌叢の変化を促進するという仮説を支持するもの。
ヒトをモデルとした研究では、大学生を対象に、大学でのストレスが乳酸菌の活性に及ぼす影響について検討された。
乳酸菌の数は、ストレスのない時期からストレスの強い試験週間まで有意に減少し、その後も減少が続いた。
非外科的手法でうつ状態を誘導し、10日間の亜慢性・軽度社会的敗北ストレス(sCSDS)に曝したマウスは、嗅球摘出後のマウスと同様にマイクロバイオームの変化を示しました。
sCSDSに曝したマウスは、対照群に比べてRikenellaceae, デスルフォビブリオ, ラクノスピラ属のOTUが増加し、アロバキュラムとMucispirillum属のOTUが減少していることが示された。
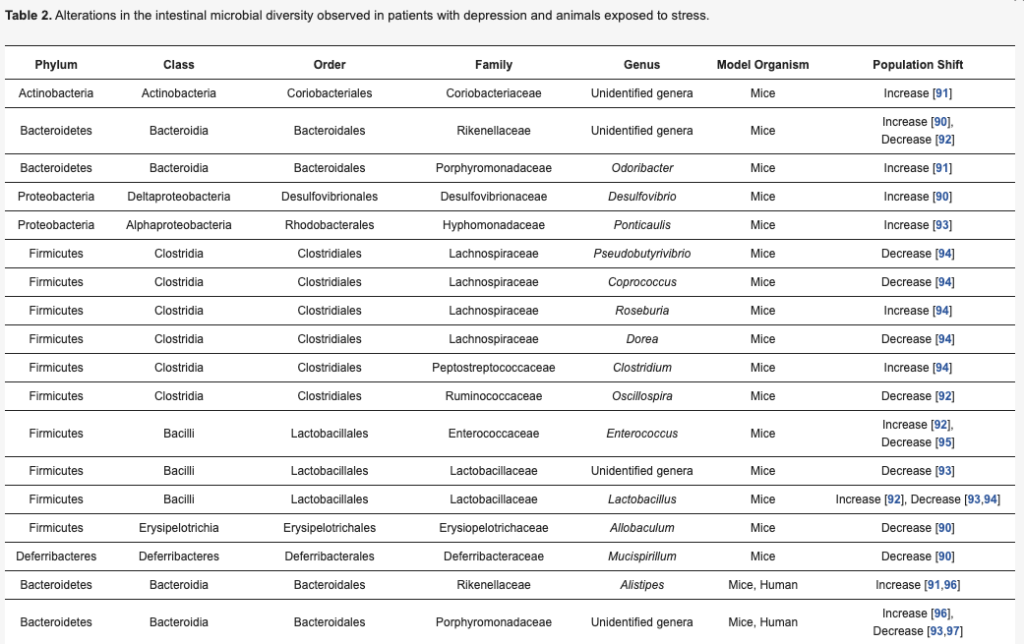
・腸内細菌叢の変化はうつ病につながるか?
近年、腸内細菌叢とうつ病の関連について多くの研究がなされている。
腸と脳の双方向コミュニケーションを可能にする複雑なメカニズムは、微生物叢-腸-脳軸を介して説明される。この経路には、免疫系、内分泌系、自律神経系のほか、これらの相互作用の制御に関与する微生物叢に由来する分子が含まれる。
現在、腸内細菌叢の変化はうつ病を引き起こす主因とは考えられていないが、重要な要素であることは間違いない。
うつ病のマウスは健康なマウスに比べて、バクテロイデスやファーミキューテスなどの有益な細菌の比率が変化している。
メタ分析によると、MDD患者では健康な対照群に比べ、ベイロネラ, プレボテラ, サテレラが少なく、放線菌は健康な対照群に比べ多く含まれていた。
さらに、MDD患者ではコプロコッカス属、フィーカリバクテリウム属、ルミノコッカス属、ビフィドバクテリウム属、エスケリキア属が減少し、パラプレボテラ属が増加することが示された。
興味深いことに、抗うつ剤との併用療法を含むプロバイオティクスは、対照群と比較して抑うつ症状に対して大きな効果があることが試験観察で示された。
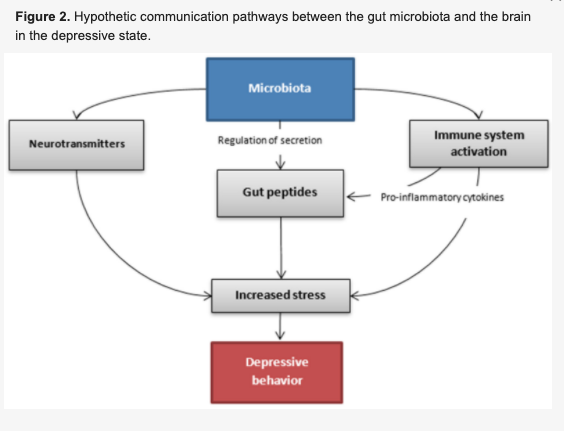
腸内細菌叢の構成が腸内ペプチドの分泌に影響を与え、その結果、生体全体における内分泌活性を調節している可能性もある。
腸管ペプチドは内分泌活性を調節し、中枢神経系とコミュニケーションをとることができる。
その働きは食物摂取だけでなく、ストレス行動やストレス反応にも関連している。
腸内細菌叢の構成が腸管バリアーの透過性に影響し、分泌された腸管ペプチドが同じように脳細胞に入るわけではなく、その効果も異なるため、生体内でのペプチドの作用も異なる。
この違いが、気分の低下、うつ病のような行動という変化をもたらす可能性がある。
・腸管ペプチドとは?
腸管ペプチドは腸内分泌細胞(EEC)から分泌される20種類以上の分子で構成され、内分泌や代謝など様々なシグナル伝達を行い、さらに中枢神経系(CNS)との情報伝達機能も有している。
最も重要な腸ペプチドは、ペプチドYY (PYY), グルカゴン様ペプチド (GLP-1), コレシストキニン (CCK), コルチコトロピン放出因子 (CRF), グレリンおよびオキシトシン。
・腸内細菌叢と腸管ペプチド分泌との関連は?
腸内細菌叢の組成の変化は、内皮タイトジャンクション(TJ)との相互作用を通じて、腸管バリアの透過性を変化させる可能性がある。
その結果、循環に吸収される腸内ペプチドの量のバランスが崩れ、脳細胞への働きに影響を与えるかもしれない。
さらに、腸内細菌叢に存在するグラム陰性菌の一部は、内毒素であるリポポリサッカライド(LPS)を分泌し、免疫カスケードの活性化や炎症性サイトカインの産生を促進させる。腸内細菌による炎症性表現型は、ストレスによる腸内ペプチドの不適切な分泌の誘因因子である可能性がある。
腸内ペプチドとは別に、微生物が分泌する代謝物や神経伝達物質(GABA、セロトニン、トリプトファン代謝物、カテコールアミンなど)など、血流に浸透して脳内の受容体に直接作用する可能性のある特異的な分子も存在する。
・腸内細菌叢組成の変化でうつ病になる可能性
ヒトおよび動物を対象とした研究で、健常者とうつ病患者の間で腸内細菌叢の組成に何らかの違いがある可能性が示唆されており、最も強い相関があるのはファーミキューテス/バクテロイデーテスの比率である。
腸内のバクテロイデーテスが多く、ファーミキューテスの割合が少ないマウスは、うつ病様行動をとる傾向があった。慢性的なストレスを与えたマウスではバクテロイデスの個体数が減少し、クロストリジウムの個体数が増加した。
うつ病患者から健康な人への糞便微生物叢移植も研究されている。
例えば、うつ病の微生物叢をコロニー化したラットでは、うつ病のような行動の症状が出ることが示された。しかし、この現象の原因となるような微生物叢の組成の変化は特に見つかっていない。
いくつかのメタアナリシスでは、プロバイオティクス使用による気分への影響を検討している。
うつ病症状を持つ患者が主に乳酸菌とビフィドバクテリウム種を含むプロバイオティクスを使用することによって利益を得る可能性があることが証明されている。
しかしプロバイオティクスにおける研究結果には一貫性がないため、さらなる研究を必要とする。
結論
一定のストレスは人間の腸内のバクテリアの比率に影響を与える可能性がある。
腸内細菌叢と脳の間のコミュニケーション経路に影響を与える要因は多く存在する。
腸内細菌叢の構成は腸内ペプチド分泌に影響を与え、内分泌系のバランスに関与している可能性がある。
炎症性因子(サイトカイン)の過剰な排泄は腸内ペプチドに影響を与え、透過性が修正された腸管バリアから吸収されるため腸内細菌叢の変化に関与し、脳に届けられるペプチドの数のバランスを崩すことにつながる。それが、マイクロバイオームの変化の引き金となり、うつ病のような行動を引き起こす可能性がある。
微生物が産生する代謝物や神経伝達物質(LPS)などの特異的な分子は、分泌されると瞬時に脳の受容体にアクセスできる。
うつ病性障害はディスバイオーシスを引き起こすのか?
腸内細菌叢の変化がうつ病につながるのか?
結論として、どちらの分子機構が生体にどのような影響を与え、うつ病の病因を説明するのに適しているかを決定することはほぼ不可能。