全世界の1%の人が罹患していると言われる統合失調症(SZ)。
一般に、SZの発症は青年期後半から成人期前半にかけて起こり、陽性症状、陰性症状、認知症状が混在する。
精神疾患の超高リスク(UHR)若年者には、精神疾患の前駆期に心理社会的機能の低下とともに期間限定の精神病症状、あるいは家族性リスク因子が存在する。
3年間の追跡調査では、UHR患者集団における初回精神疾患エピソード(FEP)への移行リスクは25%に達している。
現在の治療法は陽性症状に対しては有効だが、機能的な回復にはつながらないことが分かっている。
また、新世代の抗精神病薬は陰性症状の治療には効果がないという側面もある。
さらに、抗精神病薬はUHR患者の障害や苦痛を軽減するために使用されているが、UHR患者にとって抗精神薬による治療は多くの副作用をもたらし、一部の人々にとっては移行リスクを高めることさえある。
SZの進行をの阻止と発症予防機会は、UHR状態またはFEPの周辺にあると考えられている。
精神疾患患者において変化し続ける様々な神経・分子機構の中でも、SZ患者では酸化ストレス応答が過剰に活性化していることを示唆する証拠が増えてきている。
過去の研究では、精神疾患発症時の酸化還元代謝異常が強調されており、その後精神疾患を発症したUHR患者では、一貫して酸化的損傷の増加が観察されている。
酸化ストレスは、酸化還元バランスの変化、すなわち抗酸化防御よりも抗酸化因子の蓄積に起因し、脂質、タンパク質、核およびミトコンドリアDNA(mtDNA)に損傷を与える。
脳は特に酸化ストレスに晒されやすいが、これは神経細胞が活発に活動し、高い酸素レベルを必要とするため活性酸素の産生が多くなることに起因する。
さらに、脳には酸化物質である遊離鉄や多価不飽和脂肪酸が多く含まれており、神経細胞が特に酸化ストレスに対して脆弱な状態となっている。
リンクのレビューは、SZの病態生理学的過程を理解することで早期治療戦略を更新するために、SZ患者の血液や脳脊髄液における酸化ストレスを検討した実験的および臨床的エビデンスを概観したもの。
具体的には、SZ患者およびUHR患者の血液および中枢神経系における酵素的および非酵素的抗酸化物質と酸化ストレスマーカーのレベルの変化について述べている。
PubMedとEMBASEで1991年から2022年までに発表された査読付き論文計76本が対象。
SZ患者では血中脂質に対する酸化的損傷レベルが上昇し、非酵素的抗酸化物質レベルが低下していた。
遺伝学的研究では、患者の抗酸化機能が変化している証拠が得られた。
抗酸化物質の血中濃度は精神疾患発症前に低下し、酸化ストレスの血中濃度は症状の重症度と相関していた。
抗酸化物質であるN-acetyl cysteineによる抗精神病薬の補助療法は、精神分裂病患者に有効であると思われると結論。
Oxidative Stress and Emergence of Psychosis
・SZにおける酸化ストレス関与の証拠
SZの初期段階から、酸化ストレスの不均衡を示す証拠が増えてきているが、研究間の異質性や結果の矛盾もある。
抗酸化物質GSHの血中濃度、TAS、一酸化窒素(NO)やマロンジアルデヒド(MDA)などの酸化ストレスマーカーについては、研究間で一貫した結果が得られている。
MDAは脂質の過酸化の産物で、2つのメタアナリシスも含む複数の研究でSZ患者においてMDAとNO血中濃度が高いことが示されている。SZ患者において共通の病態生理学的経路が酸化ストレスと膜脂質の損傷をもたらすことを明らかにしている。
異なる研究で観察された抗酸化酵素の血中濃度の相違は、増加した活性酸素に反応して異なる抗酸化機構が活性化された可能性がある。
実際に、GSHとPRXの抗酸化システム間の恒常性調節は、GPx活性が低い精神病患者の神経解剖学的障害の予防に寄与している。
また、SZとFEP慢性患者の血中では、GSHとTASのレベルが一貫して低下している。
SZ患者の前帯状皮質(ACC)における抗酸化防御研究のメタアナリシスでは、対照群と比較してGSHが減少していることが明らかにされた。
これらの知見はいくつかの研究で再現され、末梢と脳のGSHレベルの間に強い関係があることが明らかにされた。
SZの病態生理における酸化ストレスの役割を理解するためには中枢神経系における血中酸化ストマーカーが必要。
例えば、内側前頭前皮質(mPFC)のGSH濃度の低さは患者の血中GPx活性の高さと相関しており、SZ患者では酸化的条件下での代償機構の欠陥があることが示されている。
SZ発症の酸化ストレス説を支持する遺伝学的証拠も存在する。
この研究で著者らは、mPFCの低SHレベルはGSH合成の律速酵素であるグルタミン酸-システインリガーゼ(GCLC)の触媒サブユニットをコードする遺伝子のトリヌクレオチドリピート多型と相関することを明らかにした。GCLC多型を持つ人はSZのリスクが高いことが判明している。
逆に最近の研究では、GCLC多型がACCのGSHレベルに及ぼす影響は観察されなかったが、治療に反応しないSZ患者を調査したところ、高リスクGCLC遺伝子型を持つ患者の高い割合でclozapineに反応することが観察された。
これらの知見は、SZは異なる病態生理学的メカニズムから生じている可能性があり、酸化ストレスがそのメカニズムの1つであることを示唆している。
さらに、メタアナリシスによってSZにおける抗酸化防御の低下を示すグルタチオン転移酵素(GSST1)をコードする遺伝子の高リスク多型の存在が明らかにされた。
その他、DISC1、PROD、NRG、DTNBP1など、SZ発症のリスクに関連するいくつかの遺伝子変異はミトコンドリア機能障害と酸化ストレスの上昇をもたらすことも判明している。
全体として、酸化ストレスがSZの病態生理に関与していることを示唆している。
酸化ストレスは神経変性疾患や代謝異常など、他の疾患にも関連している可能性があることにも注意。
また、上記の研究では、男性と女性、喫煙者と非喫煙者、SZの異なるサブタイプの間で、抗酸化酵素活性に有意な差があることがわかった。
SZの臨床ステージと抗精神病薬治療が抗酸化系と酸化状態に及ぼす影響について、慎重に検討する必要がある。
・酸化ストレスマーカーとSZの臨床経過
精神疾患発症リスクのある人を調査した研究は2件しかないが、その結果では、リスク集団で酸化ストレスが増加していることを報告している。
精神疾患家族歴のある健常者(家族性高リスク)では、血中TASは精神疾患家族歴のない健常者に比べて減少している。
興味深いことに、健常者の酸化ストレスは否定的な家族環境因子の影響を受けていなかった。
さらに、精神疾患前臨床期には、UHRの人は健常者に比べて抗酸化酵素であるSODとGPx活性が低下していた。
抗精神病薬を使用する前の精神疾患初期段階に関する研究では、酸化ストレスの上昇と抗酸化システムの欠陥が見いだされている。
ある研究では、抗精神病薬未使用のFEP患者の血中SOD活性は抗精神病薬治療中の慢性SZ患者よりも低いことが示されている。
過酸化脂質の増加は、抗精神病薬未治療のFEP患者の血中カタラーゼ、SOD、GPx、GSHの低下と関連して、酸化ストレスの増加と抗酸化システムの欠陥を示唆しているようだ。
あるメタアナリシスではFEP患者の血中TASとカタラーゼレベルが低く、それが抗精神病薬治療によって回復することが報告されている。
FEPと慢性薬物療法患者の両方で低下しているSOD血中濃度は、SZの特性マーカーであると思われる。
酸化ストレスレベルが高いほど、陽性・陰性症状評価尺度(PANSS)で評価した症状の重症度と正の相関がある一方、抗酸化物質のレベルが低いと陽性および陰性症状の重症度と負の相関があり、全体的な認知機能とは正の相関がある。
SZ患者に頻繁に観察されるガンマ応答の低下などの電気生理学的異常は、GSHレベルと相関している。血中GSH濃度はベースライン時の酸化還元マーカーに差がないにもかかわらず、FEP患者と健常者の両方において、いくつかの神経心理学的検査で測定される実行機能とも関連していた。
全体として、抗酸化機能の変化はSZ患者の症状の重症度と関連しているようだ。
抗酸化系活性低下は疾患前駆期に観察され、酸化ストレスが精神疾患への移行に原因的な役割を果たすかもしれないという仮説を裏付けている。
SZの病態生理に関する多くの理論が、それぞれのメカニズム間の相互作用を明らかにしている。
SZの神経発達仮説は、遺伝要因と環境要因の相互作用が、胎内、出生時、生後数年間の脳の発達に影響を与えるとし、これらの神経発達異常は成熟した脳で成人期初期に発現する。
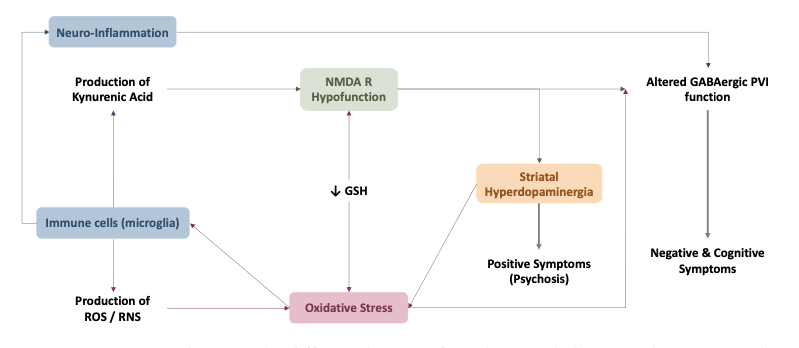
酸化ストレス仮説によれば、酸化ストレスによるダメージがこれらの変化の分子的基盤である可能性があるとしている。
脳における酸化ストレスの潜在的要因は、過剰なドーパミン自動酸化に由来する。
実際,ドーパミンやエピネフリンのような自動酸化可能な神経伝達物質は脳内に過剰に存在し,その代謝によって大量の過酸化水素(H2O2)が生成される。
脳の中でも大脳基底核、特に線条体は遊離鉄やドーパミンが多量に存在するため、酸化ストレスによる障害を最も受けやすい部位と思われる。
SZのドーパミン作動性理論は、線条体におけるドーパミン活性の増加が陽性症状の出現に関与していると提唱している。一方、意欲の減退(avolition)や無感情などの陰性症状は、前頭前野(PFC)のドパミンアレルギーで部分的にしか説明できていない。
大脳皮質抑制回路の病的変化は、SZの認知・陰性症状の治療標的として研究が進んでいる。
特に、パルバルブミンGABA作動性介在ニューロン(PVI)とオリゴデンドロサイトは、酸化ストレスに対して高い感受性を有している。そのため、PVIのミトコンドリアは高確率で活性酸素を生成し、機能的な抗酸化システムが必要とされる。一方オリゴデンドロサイトは、その高い代謝活性にもかかわらず抗酸化レベルが低いため、酸化ストレスにも非常に脆弱。
SZでは、PVIとオリゴデンドロサイトの機能が変化していることが分かっている。オリゴデンドロサイトは神経細胞の髄鞘形成に、PVIは神経細胞の同期発火に必要で、両者は脳内ネットワークの同期動態に必要である。
酸化ストレスは、SZの生理病理を説明する様々な理論の「ハブ」となっている。
ハロペリドールなどの第一世代(定型)抗精神病薬は、クロザピン、クエチアピン、リスペリドンなどの第二世代(非定型)抗精神病薬よりも患者の脂質過酸化を誘発すると考えられている。
薬物未使用のFEP患者では、非定型抗精神病薬は6週間の治療で過酸化脂質のレベルを低下させる。
定型抗精神病薬はモノアミンの代謝を増加させる結果、より多くの活性酸素を発生させるが、非定型抗精神病薬は抗酸化作用と神経保護作用を示すようだ。
興味深いことに、第一世代の抗精神病薬は錐体外路症状などの副作用をより頻繁に伴い、これは酸化ストレスと関連すると考えられている。
最近のメタアナリシスで、慢性期およびFEP患者における抗精神病薬の補助療法として抗酸化物質のN-アセチル・システイン(NAC)を用いたランダム化比較臨床試験から有望な結果が得られている。
NACによる補助療法は、ワーキングメモリーなどの認知機能とともに、患者のPANSSの陰性スコアと総スコアを改善するようだ。
現在、NACを用いた臨床試験がさらに登録されており、SZ発症におけるこの仮説の重要性を裏付けている。
また、抗酸化物質であるビタミンCの併用療法は患者の過酸化脂質を減らし、簡易精神症状評価尺度(BPRS)のスコアも低下させることが証明された。
UHR患者のオメガ3多価不飽和脂肪酸の補給は、ビタミンEには影響を与えなかったが、総GSHの血中濃度を低下させた。
抗酸化物質の種類と、病気のさまざまな段階におけるその効果についてはさらなる調査が必要。