クローン病(CD)や潰瘍性大腸炎(UC)を含む炎症性腸疾患(IBD)は消化管の慢性炎症性疾患で、先進国、発展途上国を問わず世界的に増加傾向にある。
IBD発症には遺伝的素因や食生活、ライフスタイル、工業化を含む環境負荷など様々な要因がIBD発症リスクに関与している。
現在のIBD治療の主流は薬物療法だが、中には感染症、悪性腫瘍、副作用リスクを伴うものがあり懸念が広がっていることから、IBDマネジメントにおける非薬理学的戦略の構築に関心が集まっている。
中でも食事は消化管と密接な関係があり、IBD患者では栄養不足がよく観察されることから、IBDマネジメントとしての食事介入について大きな関心が持たれている。
リンクのレビューは、IBDにおける食事曝露と介入について現代的かつ包括的に概説したもの。
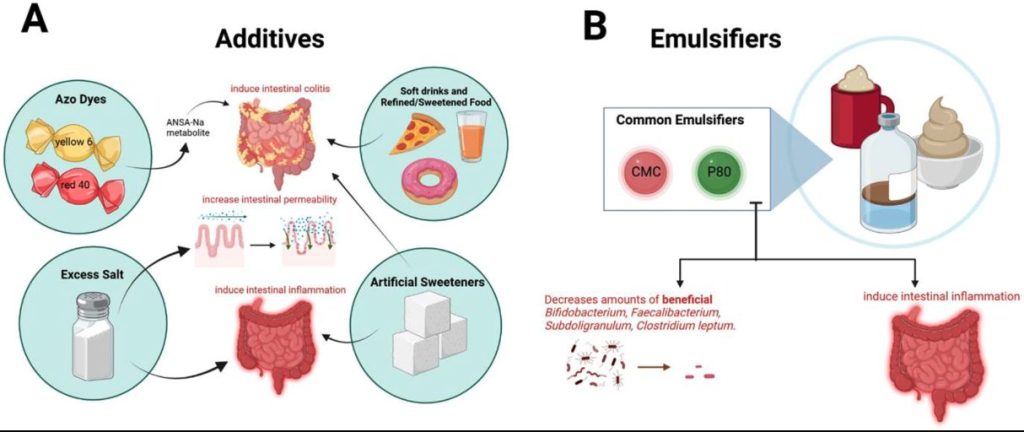
食品加工・添加物とIBDリスク
炎症性腸疾患における超加工食品
IBDのような慢性炎症性疾患の発症率が劇的に増加したのと同様に、超加工食品の消費が世界的に急速な勢いで進んでいる。
果たして食品加工とCDやUCなどの慢性疾患リスクの間に関連性は存在するのだろうか?
2021年の研究では、超加工食品(UPF)摂取とCDリスク上昇との間に有意な相関があることが発表されている。またUPFの摂取は、UCリスク上昇とも関連を示している。
食品産業で最も多く使用されている合成着色料のアゾ染料赤40や黄6などの加工食品添加物は、遺伝的高感受性マウスでIBD様大腸炎を誘発することが示されている。
常在菌であるBacteroides ovatusやEnterococcus faecalisはそれらの食用色素を代謝して1-amino-2-naphthol-6-sulphonate sodium salt (ANSA-Na) という代謝物を生成して大腸炎を誘発する可能性がある。食品添加物が腸に及ぼす有害な影響を決定する上で、腸内細菌叢が重要な役割を果たすと考えられていることからこの点は重要である。
超加工食品の摂取がIBD発症に影響を与えるメカニズムの仮説の一つとして、豊富な食物繊維を含む「未加工または最小限の加工食品(UMP)」がUPF消費量増加に置き換わったことが挙げられる。もう一つの仮説は、過剰な塩分や人工甘味料などの添加物を含む超加工食品は腸の炎症を促進するという仮説である。塩分濃度が高いと腸管透過性が高まり、糞便中の短鎖脂肪酸産生の減少や乳酸菌の枯渇を通じて炎症性サイトカインが増加し、大腸炎を悪化させることが示されている。
UPFに含まれる人工甘味料は腸の炎症を誘発する可能性があり、スクラロース/マルトデキストリン補給下で繁殖するサルモネラなどの炎症性細菌は粘液産生の低下により腸上皮細胞に影響を与えて大腸炎感受性を高めることがわかっている。
ある研究では、UPF摂取量が多いほどIBD発症リスクが高く、特に5食/日以上の摂取はリスクが高いことが示されている。この研究では加工肉の摂取量が多いとIBDリスクが高くなることと関連することも示されている。
また、ソフトドリンク摂取量が最も少ない場合(0.5食/週未満)と比較して、最も多い場合(3食/週以上)はIBDリスクが高区なることが報告されている。3食/週以上のソフトドリンク摂取、100g/日以上の精製甘味料入り食品の摂取、100g/日以上の塩辛いスナックの摂取はすべてIBD高リスクと関連している。
さらに、揚げ物摂取量が1日あたりわずか1食でも、1日あたり0食の場合と比較してIBDリスクが最も高くなることが示されている。
最近の研究では、未加工および最小限の加工を施した食品の摂取は、クローン病(CD)リスク低下と関連していることが示されている。
別の研究では、野菜摂取量が少なく、精製砂糖や清涼飲料水の摂取量がと潰瘍性大腸炎(UC)の高リスクと関連することが報告されている。
イランで行われた研究では、低脂肪乳製品、ナッツ、魚、ドライフルーツ、植物油、オリーブオイル、果物、野菜(すべて未加工)に分類される「健康的」な食事の遵守はUCに対する予防効果があったのに対し、加工肉、赤肉、加工/高脂肪乳製品、漬物、動物性脂肪、ポテトチップ、卵、加工砂糖、加工デザートの多い「非健康的」な食事の遵守はUCリスクの上昇と相関することがわかっている。
未加工の白身肉、未加工の赤身肉、乳製品、でんぷん質食品、果物、野菜、豆類の摂取はIBDリスクと関連がなかったことを考えると、IBD発症リスクは食品そのものよりも食品の加工法に依存する可能性がある。
炎症性腸疾患における乳化剤
乳化剤はIBD発症に影響する微生物相異常や炎症反応に関与している。
乳化剤は食品加工において保存性を高めるために頻繁に使用されるが、乳化剤の中には炎症促進作用を持つものがある。
最も研究されている乳化剤は食用油、アイスクリーム、ケーキミックス、アイシング、チョコレートシロップなどによく含まれているポリソルベート80(P80)とカルボキシメチルセルロース(CMC)で、両乳化剤の摂取は腸内細菌叢に悪影響を及ぼすことが判明している。
これらの乳化剤に曝露したマウスモデルでは、腸管粘膜を覆う粘液層への微生物叢の侵入が誘発されることがわかっている。そういった微生物叢の変化は慢性的な腸の炎症を誘発し、”遺伝的に影響を受けやすい宿主”では大腸炎、”野生型宿主”では代謝異常が引き起こされることが確認された。また、P80を摂取したマウスでは回腸炎が悪化し、腸内細菌叢のα-多様性が減少、Enterobacteriacaeaeを含む硫化物生成菌の増殖と、IBD関連種であるProteus mirabilisのスウォーミング行動が有意に増加した。Proteus mirabilisにおけるスウォーミング行動の促進は、IBD病態と関連している。
P80の投与はヒト腸内細菌叢にもIBDと同様の変化を起こし、有益なビフィドバクテリウムの減少、FaecalibacteriumやSubdoligranulum、Clostridium leptumなどの重要なSCFA生産菌が減少することがわかっている。
ヒト対象試験ではCMC摂取が腸内細菌叢と糞便メタボロームを有害に変化させることが観察されている。
20種類の食用乳化剤no調査deha、腸内細菌叢に変化をもたらす乳化剤はP80とCMCだけではく、カラギナン、ガム、ヒマワリレシチン、モノジグリセリドも腸内細菌叢の乱れにつながることが明らかになった。
上記の知見から、IBD患者ではこれらの乳化剤が粘膜バリアを破壊し、大腸炎を促進し、腸内細菌叢とその機能を変化させる影響を持つため、CMCとP80の摂取を十分に考慮する必要がある。
除去食・排泄食
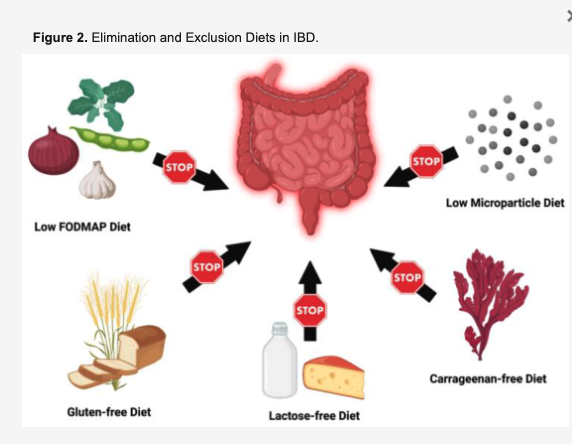
低FODMAPダイエット
FODMAPは過敏性腸症候群(IBS)のために作られた食事法で、発酵性、オリゴ糖、二糖、単糖、ポリオールの略で、小腸で吸収が悪く発酵が激しい短鎖炭水化物が豊富に含まれている。発酵と吸収の悪さが、腹部膨満感や下痢、腹痛を引き起こすと考えられている。
複数の研究では、IBD患者が低FODMAP食を摂取した場合、通常の食事と比較して膨満感、腹痛、下痢などのIBS様症状および症状全体の重症度スコアが有意に低下することが示されている。
また、低FODMAP群では便の硬さが「正常」である割合が有意に増加したことも報告されている。
一方で、高FODMAP食を食べているIBD患者は症状負担の増加を報告している。例えば、IBD患者に3日間のフルクタン(短鎖糖の一例)チャレンジを行ったところ、疼痛、鼓腸、便意が増加している。
しかし、低FODMAP食にも欠点がある。
低低FODMAP食は症状を軽減するが、同時に腸内細菌叢の多様性を低下させて腸全体の健康を低下させることでIBD患者の全体的な転帰を悪化させる可能性がある。
カラギナンフリー食
IBD患者で研究中のもう一つの除去食はカラギナンフリー食。
カラギナンは、特に乳製品や加工食品の増粘剤、安定剤、食感改良剤、乳化剤として使用されている食品添加物。
カラギナンの暴露によって大腸の炎症が増加することが示されている。
寛解期にある12名のUC患者を対象に、プラセボカプセルとカラギナンを含むカプセルの投与に無作為に割り付けた結果、「カラギナンを含まない」グループでは症状再発率が低下し、IL-6や便中カルプロテクチンのレベルが低下している。
乳糖不使用の食事
ラクトースフリーダイエットは、乳糖不耐症者の消化器症状に対する主要な治療法となっている。IBD患者集団の乳糖不耐症率は一般集団と同程度だが、CDおよびUC患者で乳糖不耐症率が有意に高いことがわかっている。これまで乳糖不耐症と診断されていなかったIBD患者が乳糖不耐症食に変更すると症状が有意に改善することも明らかになった。
グルテンフリーダイエット
グルテンフリー食は食餌性グルテン過敏症による小腸の免疫介在性炎症性疾患であるセリアック病治療のために開発された。
セリアック病とIBDの炎症性病態が類似していることから両疾患の関連性に関心が集まっている。
しかしこれまでの研究結果は矛盾しており、両者の関連性についてはまだ議論の余地がある。
グルテンフリー食のIBD症状に対する効果は依然として不明であり、さらなる評価が必要。
低微粒子食
マイクロパーティクルは0.1~1.0μmの粒子と定義され、腸のリンパ組織の細胞に蓄積されて炎症性変化と関連するとされている。表面に帯電した微粒子は異常な免疫反応を刺激して腸炎を引き起こすという仮説がある。
微粒子複合体にさらされると腸管培養や腸管前膜の生検で炎症性サイトカイン、特にIL1-Bの分泌が増加することが研究で示されている。これらの知見から食事による微小粒子の摂取はIBD患者などの影響を受けやすい患者において炎症の亢進につながる可能性があると考えられているが、CDにおけるより大規模なフォローアップ研究では否定的な研究が観察されるなど、IBDにおける低微粒子食の効果についてはまだ結論が出ていない。
特定の食事介入
地中海式食事法(Mediterranean Diet)
地中海式ダイエット(MD)は、野菜、果物、ナッツ、豆類、不飽和脂肪、魚と乳製品の適度な摂取を特徴とし、飽和脂肪、肉、甘いものは控えめに摂取する食事形態。
MDは大腸がん、心血管疾患、糖尿病の減少に関連することから、MDがIBDに与える影響について大きな関心が持たれている。
腸の炎症マーカーを軽減するなどIBD症状軽減に役立つ一定の観察はなされているものの、統計的に有意な結果を示す研究はまだない。
特異的炭水化物ダイエット
IBDの補助療法として、SCD(Specific Carbohydrate Diet:特異的炭水化物ダイエット)に関心が集まっている。SCDは許可される食品と除外される食品を規定しており、ジャガイモや山芋のようなでんぷん質の野菜を除き、すべての新鮮な果物や野菜が認められる。
未加工の肉類は許可されるが、加工肉や燻製肉は認められない。
穀類は禁止。
甘味料として蜂蜜は許可されるが、精製砂糖は認められない。
乳製品は禁止されているが、特定のチーズは例外である。
IBDにおける食事療法の栄養学的妥当性は重要な関心事で、SCDの有効性は小児患者を対象に研究されているが一様にサンプルサイズが小さい。26名の小児患者(CD20名、UC6名)を対象とした研究では、PCDAIの平均値がベースライン時の14.5±16.4から6ヵ月後には3.1±5.1に低下している。アクティブCD(PCDAI>10)患者9名では、平均値はベースラインで32.8±13.2、6ヵ月後には8.8±8.5だった。PUCAIでも同様の低下が認められた。
他の研究では小児CD患者9名を52週間追跡調査し、ベースライン値と比較して12週目にはPDCAIが低下、Harvey-Bradshaw Index(HBI)およびLewis score(LS)も低下した。
52週後、PDCAIとHBIの改善は持続したがLSの改善は持続せず、カプセル内視鏡検査で粘膜が治癒した患者は7人中2人だけだった。
417名の成人IBD患者(70%女性、平均年齢34.9歳、CD47%、UC43%)を対象とした調査では、ベースライン時の4%に対し、12週目に42%の患者が症状の寛解を報告している。
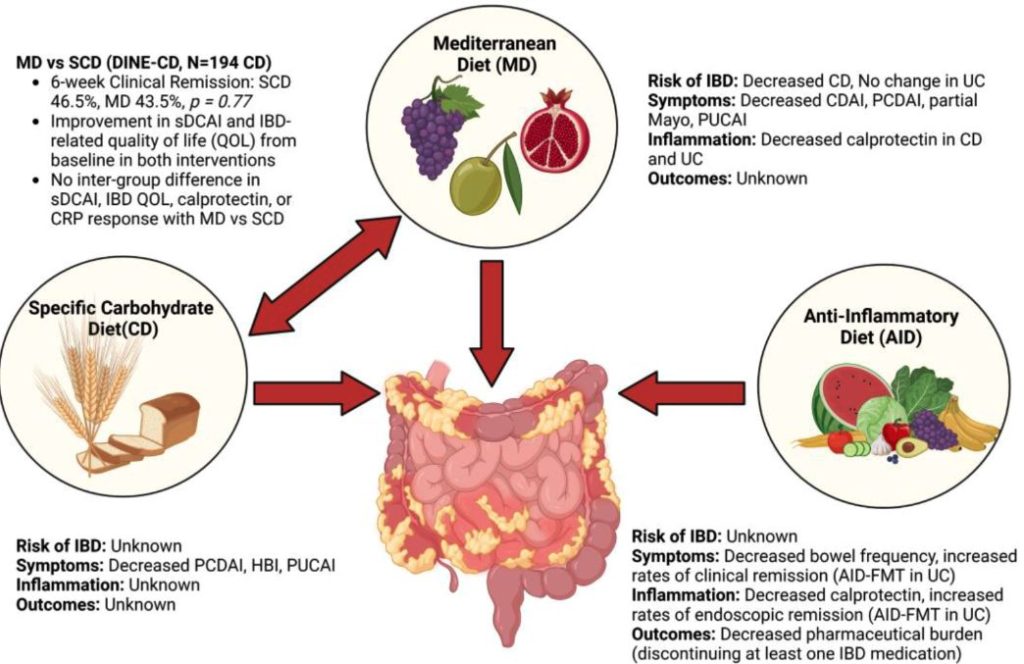
地中海食と特異的炭水化物食の比較
軽度から中等度のクローン病(CD)患者194名を対象とした試験(Diet to Induce Remission in Crohn’s Disease: DINE-CD)においてMDとSCDの有効性が比較されている。
6週間後に症状寛解を達成した患者の割合は、両群間で差がなかった(SCD46.5%, MD43.5%)。両群ともベースラインと比較してsCDAIとIBD関連QOLの改善がみられたが、両群間に差はなかった。同様に、カルプロテクチンやCRPの反応にも群間差はなかった。
どちらの食事群とも重篤な有害事象の発生率は低く、忍容性は良好だった。
ベースライン時および6週目のマイクロバイオームのαおよびβの多様性は、症状の寛解と関連せず、値は試験期間中安定したままだった。
どちらの食事も軽度から中等度のCDに中程度の効果を示したが、SCDはMDより優れてはいなかった。
ケトジェニック・ダイエット
ケトジェニック食は短鎖脂肪酸(SCFA)を産生する常在菌(Bifidobacterium、Lactobacillus、Bacteroides、Faecalibacterium、Clostridium、Ruminococcusなど)の増殖に影響を与え、子どもの腸内に良い影響を与えることが示されている。小児のIBDを軽減するKDの抗炎症作用はSCFA産生菌が作る抗炎症性βOHBの増加によるものと考えられる。酪酸とβOHBは腸の炎症を抑え、炎症性サイトカインの産生を抑制し、マクロファージにおけるヒストンアセチル化を促進する。
SCFA産生菌は腸管バリアの完全性を促進し、IBD結腸粘膜のディスバイオシスを緩和する上で大きな役割を担っている。KDは小児の腸内SCFA産生菌に影響を与えることから、KDはIBDの寛解誘導や炎症抑制のためのアプローチとして可能性が見込まれる。
KD、低炭水化物食(LCD)、普通食(ND)を与えたマウスの腸内細菌叢と代謝の変化を比較した研究では、腸内炎症に対するKD改変腸内細菌叢の有益性が明らかになり、KDはLCDと比較して炎症反応を有意に抑制し、腸管バリア機能を保護し、自然リンパ球(ILC3)産生を抑制し、関連炎症性サイトカインの発現を低下させることを発見している。
しかし一方で、KDは腸管透過性の増加、腸管上皮バリア遺伝子の発現の減少、体重減少の増加、DAIスコアおよび組織学的スコアの増加、結腸長(腸管炎症の代理指標)の減少により大腸炎を悪化させることを示す研究もある。その研究(マウスモデル)では、KDが腸内微生物の改変、腸内細菌叢のメタボローム変化、腸管バリアの破壊、血液と大腸の炎症の増悪により腸管損傷を増加させることを示している。
さらに他の研究では、ケト食は「プロテオバクテリア、エンテロバクテリア、ヘリコバクター、エシェリヒア・シゲラなどの病原性細菌が増加し、潜在的に有益なエリシペロトリカスが減少してDSS誘発大腸炎を悪化させる」ことが示されている。
ケトジェニック食は炎症細胞を減少させるが、腸内細菌叢に「好ましくない」影響を与えることがほとんどで注意が必要。
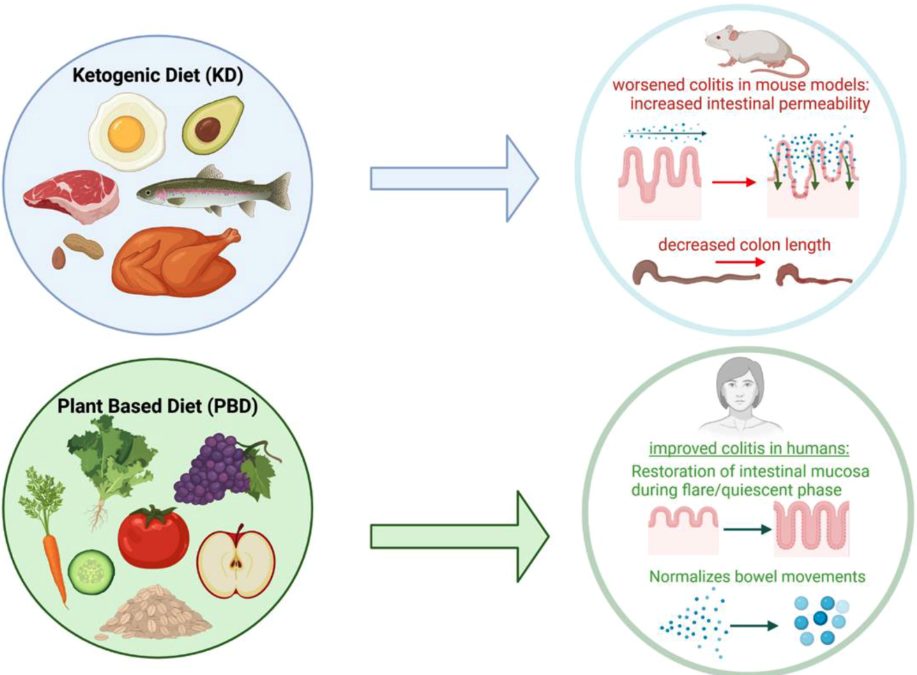
Plant-Based-Diet
発展途上国では動物性タンパク質、トランス脂肪酸、精製糖質といったの欧米食に移行しているためIBD症例が増加している。12万5千人の成人を30年以上追跡調査したデータから、欧米食(調理済み食品、加工飲料、赤肉、野菜や果物がほとんどない)摂取とCDリスクの高さに相関があることが明らかになっている。赤身/加工肉、加工糖質、飽和脂肪の過剰摂取は、上皮バリア機能と腸内細菌叢のディスバイオシスと強く関連する。
植物性食品は有益な細菌群の豊富さを促進することで、欧米食の影響を緩和することが示されている。植物ベース食(PBD)はIBDフレア時の腸の回復を助け、静止期の腸内共生を維持するようだ。活発なフレア期にあるクローン病患者(厳格なCDを持つ患者でも)は、大量の食物繊維を含む植物ベースの食事(PBD)を摂取しても問題ないことも報告されている
PBDは便秘の患者や下痢や便が緩い患者の便通を正常化する。過去のクローン病46例を対象とした研究ではインフリキシマブとPBDの併用で96%の寛解率が誘導されたが、IBD患者の30%がインフリキシマブに反応しないことを考えるとこの結果はエキサイティングである。
またUC再発を初めて経験した患者では、PBDを治療薬として用いた場合1年後の再発率は14%にとどまっている。軽症のUCの場合、薬物療法ではなくまずPBDで治療することで約3分の1の患者で寛解を誘導できると研究者は述べている。2020年のフォローアップ研究では、インフリキシマブとPBDを第一選択療法とすることで重症UC患者17名中13名を寛解に誘導し、寛解率は76%に達している。第一選択療法としてのインフリキシマブとPBDは、過去の文献で報告された結果よりも重症UC患者の短期および中期の転帰を改善することも指摘されている。
抗炎症食
抗炎症食はIBDで見られる上皮バリア機能障害、微生物異常症、免疫反応の異常を緩和することを目的に、腸内細菌叢を乱す可能性のある精製または加工された複合炭水化物を制限すること、プレおよびプロバイオティクスを増やすこと、脂肪酸はn-3-PUFAの多い食品を、n-6-PUFAを避けることから構成される食事療法。
さらに個々の食事パターンを見直し、栄養の偏りや不耐性を特定、症状に応じてブレンド、粉砕、調理などの方法で食感を段階的に調整し、粘膜の治癒を促進することも重要な要素。
抗炎症食は、病原性微生物の増殖に寄与したり腸管内腔の炎症プロセスを促進したり、それによって粘膜免疫反応を媒介する可能性のある食品、添加物、成分への接触を制限することによって、IBDの内科的治療を支援するように設計されている。
11名のIBD患者(CD8名、UC3名)を対象に抗炎症食(IBD-AID)を4週間以上続けた小規模な研究では、症状、重症度、薬剤負担を軽減し、臨床結果に影響を与える可能性が示されている。IBD-AIDに従った患者は少なくとも1つのIBD治療薬を中止した。
抗炎症食の摂取により腸内細菌叢が直接操作されることを示すさらなる証拠は、抗炎症食とマルチドナーFMTを併用した場合に見出されている。このプロトコルに従った軽度から中等度の活動性UC患者は、その後1年間深く持続的な寛解に入った。抗炎症食の推奨(FMT-AID)に8週間従った後で標準的な内科治療(SMT)と比較すると、FMT-AIDはSMTよりも8週間後の臨床反応(寛解度)が優れていた。
また、抗炎症食は48週まで深い寛解を維持することにおいてSMTより優れていた。
FMT-AID群の患者は、標準的な内科的治療のみを行った患者と比較して総繊維摂取量は少なかったが、水溶性繊維摂取量は同程度だった。
腸内細菌叢を操作する戦略の組み合わせは寛解を誘導する上で特に強力であると思われ、ステロイドを使用しない深い寛解を維持するためには抗炎症性食が鍵となる可能性がある。
高繊維食
腸内細菌叢による食物繊維の短鎖脂肪酸(SCFA)への変換によって促進される抗炎症作用について多くの研究で議論されており、食物繊維摂取量を増やすことでIBD患者の炎症を抑えることができるかどうかも研究されている。
IBDマウスモデルでは、高脂肪食が腸のバリア機能と常在細菌叢を阻害することで腸の炎症を悪化させることが実証されている。
寛解期または軽症UC患者17名を対象とした研究では、低脂肪・高繊維食は炎症マーカー改善と腸内細菌異常の減少に関連していた。さらに、低脂肪・高繊維食の後に採取された糞便サンプルのメタボローム解析ではベースライン時に採取されたサンプルよりも酢酸量が有意に多いことが明らかになった。低脂肪・高繊維食の後に採取された糞便サンプルは腸内異常マーカーが少ないことが特徴的だった。高繊維食はUCの寛解期にある患者に有効である可能性がある。
排他的経腸栄養法(EEN)
排他的経腸栄養法(EEN)とは、必要なカロリーや栄養をすべて液体で摂取する方法。
経腸栄養剤は主にアミノ酸とペプチドで構成され、EENにより経口摂取を制限することでCDの誘因となりうる食事性抗原を減らすことが狙い。
CDにおけるEENの臨床的な利点がいくつかの研究で検討されている。抗TNF維持療法を受けているCD患者のメタ解析では、EENが長期寛解の確率を高めることが示された。
栄養不良のCD患者149を対象とした研究では、術前の経腸栄養サポートは腹腔内敗血症合併症の減少につながる傾向があったが決定的な証拠はなかった。
手術を受けたCD患者300人を対象とした研究では、術前の経口経腸栄養は忍容性が高く、術後30日の合併症の減少に関連することが示されている。
新たな食事療法
IBDの食事療法
UCにおける減硫食
IBD患者を対象に新しい食事療法が研究されており、その一つに減硫食介入でがある。
この研究は、硫化水素と硫酸還元菌のレベルが高いために起こるディスバイオシスがUCの病因に関与しているという前提で行われている。
Mayoスコアで測定される疾患の主要アウトカムについて、減硫食(硫酸/硫黄を多く含む食品、食品添加物、飲料の低減、硫黄含有サプリメントの制限、大腸の硫酸還元菌の過剰増殖抑制を含む)と従来の管理の効果を比較している。
UCにおける発酵食品
発酵食品が胃腸の炎症や腸内細菌叢組成に影響を与えることは先行研究で実証されている。
マウスモデルでは発酵植物エキスがデキストラン硫酸ナトリウム誘発性大腸炎と炎症性サイトカインの産生を抑制することが示されている。
IBDでない被験者でも、発酵植物エキスを補給すると炎症抑制に中心的な役割を果たし、Firmicutes phylaとClostridiales orderの増加が誘導されることがわかっている。
同様に、健康な成人被験者を対象とした研究では、発酵食品を多く含む食事は微生物叢の多様性を着実に増加させ、炎症マーカーを減少させることが明らかになった。
まとめ
食事とIBDリスク、病態、治療法としての役割との関連性を評価する研究が数多くあることは、患者や臨床医の大きな関心と臨床的必要性を裏付けている。
超加工食品はIBD発症率を高め、特定の食品添加物や乳化剤は腸内細菌叢の恒常性を乱して腸の炎症を誘発する可能性がある。
除外食や除去食はIBD患者の症状改善と関連する可能性があるが、炎症マーカーの減衰や臨床転帰の改善に関する決定的な根拠は存在しない。
地中海食や特定炭水化物食などの特定の食事介入は、疾患活動性やカルプロテクチンを低下させる可能性があるが、サンプルサイズが小さいため限界がある。
高繊維食、植物性食、ケトジェニック食および抗炎症食などの食事介入はすべて、程度の差こそあれ、症状の軽減、炎症負荷の改善およびQOL指標の改善を示すが、これらの食事介入に対する反応には大きな異質性が存在する。
小児CD患者のサブセットや外科的介入を受けるCDでは、排他的経腸栄養が有益である可能性がある。
食事は現在の標準的IBD治療による臨床的寛解を誘発または維持するための補助的な役割を果たす可能性がある。